
【题目】有关下列三个反应的叙述,正确的是( )
①2H2S+SO2=3S↓+2H2O
②S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
③3S+6KOH![]() 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
A.反应①说明SO2能与酸反应,具有碱性氧化物的性质
B.反应②改用稀H2SO4,则能放出氢气
C.反应②和③说明S具有两性元素的性质
D.反应③说明S既具有氧化性又具有还原性
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50mol/LNaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、______、_______以及等质量的两片纸片。
(2)计算。配制该溶液需取NaCl晶体_______g。
(3)配置过程。
①天平调零。
②称量过程中NaCl晶体应放于天平的_______(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
④溶解、冷却,该步实验中需要使用玻璃棒,目的是________。
⑤转移、洗涤。在转移时应使用_____引流,需要洗涤烧杯2-3次是为了______。
⑥定容、摇匀。
⑦将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(4)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“高”、“偏低”或“无影响”)。
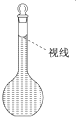
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验,能正确描述其反应的离子方程式是
A.用Na2SO3溶液吸收少量Cl2:3![]() +Cl2+H2O = 2
+Cl2+H2O = 2![]() +2
+2![]() +
+![]()
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2=O2↑+2H++2Fe2+
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:![]() +OH-=NH3·H2O
+OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分前36号元素的性质或原子结构如下表
元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
【答案】 氮原子2p轨道半充满,能量低,稳定 否 F的电负性最大,只能得电子 2s22p5 2 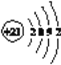 能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
【解析】试题分析:R元素的基态原子最外层有3个未成对电子,次外层有2个电子,R是N元素;S元素的单质能与水剧烈反应,所得溶液呈弱酸性,S是F元素;T元素的基态原子3d轨道上有1个电子,T是21号元素Sc; X元素的原子核外有12个电子,X是Mg元素。
解析:根据以上分析,(1)R是N元素,氮原子2p轨道半充满,能量低,稳定,所以第一电离能要大于其同周期相邻的O元素。
(2)元素F的电负性最大,只能得电子,所以F元素没有正价;F元素的最外层电子排布式为2s22p5。
(3)Sc原子的核外电子排布式是1s22s22p63s23p63d14s2,所以N能层上电子数为2,其原子结构示意图为 。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
【题型】综合题
【结束】
20
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________。
(2)写出Y元素最高价氧化物的水化物分别与HCl、NaOH溶液反应的离子方程式_______________________、_________________________。
(3)写出Z与Y的电子排布式______________、________________。
(4)元素T与氯元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是__________(填元素符号),理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从硅的氧化物可以制取硅单质,主要化学反应如下:粗硅的制取:
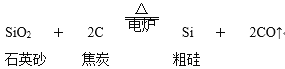
由粗硅制纯硅(常用方法):Si(粗)+2Cl2![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si(纯)+4HCl
Si(纯)+4HCl
根据以上反应,回答下列问题。
(1)在制取粗硅的反应中,焦炭的作用是什么___?
(2)在由粗硅制纯硅的反应中,氯气(Cl2)与Si的反应属于什么类型的反应___?SiCl4与H2的反应属于什么类型的反应___?H2的作用是什么___?
(3)在半导体工业中有这样一句行话:“从沙滩到用户”,你是如何理解的___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入如图所示的装置中,以检验产生的气体中是否含有SO2、SO3。
请回答下列问题:
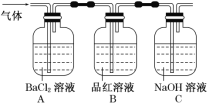
(1)写出KSCN溶液与Fe3+反应的离子方程式:____。
(2)操作②中观察到的现象和结论是____;_____。
(3)操作②中最后要将通过品红溶液的气体通入NaOH溶液中的原因是___,有关反应的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.丙烯的结构简式为CH2CHCH3
B.分子式为C4H10O属于醇类的有机物有4种
C.分子式为C2H4O2和C3H6O2的有机物一定互为同系物
D.![]() 名称为丙酸甲酯
名称为丙酸甲酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有两种同分异构体。科学研究表明,两种分子都具有抗癌活性。
(1)吡啶分子是大体积平面配体,其结构简式如图所示![]() ,氮原子的杂化轨道方式是_____。吡啶分子中,各元素的电负性由大到小的顺序为_____。吡啶分子中含有_____个σ 键。
,氮原子的杂化轨道方式是_____。吡啶分子中,各元素的电负性由大到小的顺序为_____。吡啶分子中含有_____个σ 键。
(2)二氯二吡啶合铂分子中存在的微粒间作用力有_____(填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
(3)二氯二吡啶合铂分子中,Pt2+的配位数是 4,但是其轨道杂化方式并不是 sp3。简述理由:_____________。
(4)其中一种二氯二吡啶合铂分子结构如图所示,该分子是_____分子(选填“极性”、“非极性”)。
![]()
(5)CO(NH2)2 易溶于水的最主要原因是_________________________。
(6)Si 元素以 Si-O-Si 链构成矿物界,由许多四面体(图 l)连接成无限长的单链或双链(图 2)结构。图 2 所示的多硅酸根离子的化学式通式为_____(以含正整数n 的代数式表示)。
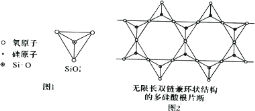
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com