
【题目】物质的量浓度相同的下列溶液 ①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4HCO3,其NH4+浓度由大到小的顺序是
A. ②③①④ B. ④①③②
C. ②①④③ D. ②④①③
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜投入一定量的稀硝酸中,铜完全溶解后,测得反应后溶液中Cu2+和NO3﹣的物质的量之比为3:7,则参加反应的HNO3与反应前HNO3的物质的量之比是( )
A.1:1
B.8:9
C.3:4
D.6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
Ⅰ.硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因_____________,如何才能用热水配制出澄清的较浓的CuSO4溶液_______________;
Ⅱ.依据反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
滴定前的准备:
①→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
①称量绿矾样品质量为m g,配成100 mL待测溶液,②取体积为10.00mL的待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度为1.0molL﹣1的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
请回答下列问题:
(1)将步骤1中的操作补充完整:
①__________________________,②__________________________
(2)KMnO4(H+)溶液应装入______式滴定管进行滴定;如何知道滴定到达终点?___________
(3)下列操作会导致测定结果偏低的是____________________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定后滴定管尖嘴处悬有溶液未滴落
(4)实验测得FeSO4的质量分数为____________(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
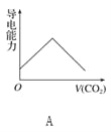
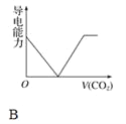

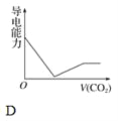
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
反应速率最快的是
A. v(A)=0.20mol·L-1·min-1 B. v(B)=0.30 mol·L-1·min-1
C. v(C)=0.40 mol·L-1·min-1 D. v(D)=0.50 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g)![]() 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g)![]() O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g)![]() 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g)![]() 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
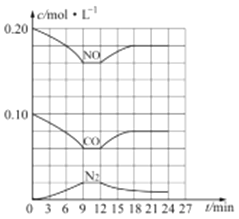
①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北魏贾思勰《齐民要术·作酢法》这样描述苦酒:“乌梅苦酒法:乌梅去核,一升许肉,以五升苦酒渍数日,曝干,捣作屑。欲食,辄投水中,即成醋尔。”下列有关苦酒主要成分的说法正确的是( )
A. 苦酒的主要溶质是非电解质 B. 苦酒的主要溶质是弱电解质
C. 苦酒的主要溶质是强电解质 D. 苦酒的溶液中只存在分子,不存在离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山银山,我国科研人员在探究如何降低大气中氮氧化物与碳氧化物的含量方面做出了巨大贡献,并取得了显著的成绩。
(1)下列关于氮氧化物与碳氧化物的说法中正确的是_____(填字母)。
A.CO2、NO2均属于酸性氧化物
B.NO、CO均不能用排空气法收集
C.除去NO中混有的NO2的方法是将混合气体通入足量氢氧化钠溶液中
D.除去CO中混有的CO2的方法是将混合气体通入足量氢氧化钠溶液中
(2)已知:N2(g)+O2(g)![]() 2NO(g)ΔH1=+180.5kJ/mol;
2NO(g)ΔH1=+180.5kJ/mol;
CO(g)![]() C(s)+1/2O2(g)ΔH2=+110.5kJ/mol;
C(s)+1/2O2(g)ΔH2=+110.5kJ/mol;
C(s)+O2(g)![]() CO2(g)ΔH3=-393.5kJ/mol。
CO2(g)ΔH3=-393.5kJ/mol。
则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ΔH=__________
N2(g)+2CO2(g)ΔH=__________
(3)反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。由此可知,提高尾气净化效率的最佳途径是_________;若要净化汽车尾气的同时提高该反应的反应速率和NO的转化率,且只改变一个反应条件,则应采取的措施是_________。
2CO2(g)+N2(g)可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。由此可知,提高尾气净化效率的最佳途径是_________;若要净化汽车尾气的同时提高该反应的反应速率和NO的转化率,且只改变一个反应条件,则应采取的措施是_________。
(4)某科研小组根据反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)来探究起始反应物的碳氨比[n(CO)/n(NO)]对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分的转化率和氯气的体积分数的变化如图所示.
N2(g)+2CO2(g)来探究起始反应物的碳氨比[n(CO)/n(NO)]对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分的转化率和氯气的体积分数的变化如图所示.

①根据图像推测曲线转化率1表示的是______ (填“CO”或“NO”)。
②A点时,n(CO)/n(NO)=_________,此时反应的平衡常数K= __________(请填写数值与单位)。
(5)煤炭在O2/CO2的气氛中燃烧会产生CO,有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。该提议_______(填“可行”或“不可行”), 理由是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com