
【题目】请按要求回答下列问题:
Ⅰ.硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因_____________,如何才能用热水配制出澄清的较浓的CuSO4溶液_______________;
Ⅱ.依据反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
滴定前的准备:
①→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
①称量绿矾样品质量为m g,配成100 mL待测溶液,②取体积为10.00mL的待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度为1.0molL﹣1的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
请回答下列问题:
(1)将步骤1中的操作补充完整:
①__________________________,②__________________________
(2)KMnO4(H+)溶液应装入______式滴定管进行滴定;如何知道滴定到达终点?___________
(3)下列操作会导致测定结果偏低的是____________________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定后滴定管尖嘴处悬有溶液未滴落
(4)实验测得FeSO4的质量分数为____________(用含a、b的代数式表示)
【答案】 Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,故产生浑浊 应加入少量H2SO4 查漏 排气泡 酸 溶液由浅绿色变紫红色,且半分钟内不褪色 C ![]()
【解析】Ⅰ、(1)因Cu2+水解产生Cu(OH)2,该反应是吸热反应,加热促进水解,故产生浑浊;硫酸浓度增大,平衡逆向移动,能得到澄清的较浓的CuSO4溶液,故答案为:Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,故产生浑浊;应加入少量H2SO4;
Ⅱ.(1)滴定前首先需要加成滴定管是否漏液,然后用待装溶液润洗,装液,排气泡,调节液面在零刻度或零刻度以下,并记录初始读数,故答案为:查漏;排气泡;
(2)KMnO4(H+)溶液具有强氧化性,能够发生乳胶管,应装入酸式滴定管进行滴定;滴入最后一滴KMnO4溶液恰好由浅绿色变紫红色,且半分钟内不褪色,说明到达滴定终点,故答案为:酸;溶液由浅绿色变紫红色,且半分钟内不褪色;
(3)A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定,标准液浓度减小,所需v(标准)增大,根据c(待测)= 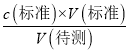 判断可知c(待测)偏大,故A错误;B.锥形瓶用蒸馏水洗涤后未用待测液润洗,所需v(标准)不变,根据c(待测)=
判断可知c(待测)偏大,故A错误;B.锥形瓶用蒸馏水洗涤后未用待测液润洗,所需v(标准)不变,根据c(待测)=  判断可知c(待测)不变,故B错误;C.读取标准液读数时,滴定前平视,滴定到终点后俯视,所需v(标准)偏小,根据c(待测)=
判断可知c(待测)不变,故B错误;C.读取标准液读数时,滴定前平视,滴定到终点后俯视,所需v(标准)偏小,根据c(待测)= 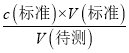 判断可知c(待测)偏小,故C正确;D.滴定后滴定管尖嘴处悬有溶液未滴落,所需v(标准)偏大,根据c(待测)=
判断可知c(待测)偏小,故C正确;D.滴定后滴定管尖嘴处悬有溶液未滴落,所需v(标准)偏大,根据c(待测)=  判断可知c(待测)偏大,故D错误;故选C;
判断可知c(待测)偏大,故D错误;故选C;
(4)由题意可知10.0mL待测液与(b-a)×10-3L 1 molL-1的KMnO4完全反应,
5Fe2+ + MnO4-+8H+═5Fe3++Mn2++4H2O,
5 1
0.01L×c(Fe2+) 1molL-1×(b-a)×10-3L
则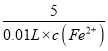 =
=![]() ,解得:c(Fe2+)=0.5(b-a)molL-1,则100mL待测溶液中FeSO4的质量为0.5(b-a)molL-1×0.1L×152g/mol= 7.6(b-a)g,所以样品中FeSO4的质量分数为
,解得:c(Fe2+)=0.5(b-a)molL-1,则100mL待测溶液中FeSO4的质量为0.5(b-a)molL-1×0.1L×152g/mol= 7.6(b-a)g,所以样品中FeSO4的质量分数为![]() ×100%=
×100%=![]() ,故答案为:
,故答案为: ![]() 。
。


科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )
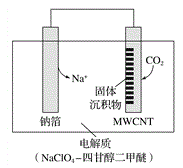
A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在溶液中不能大量共存的是
A. H+、Cl-、Na+、NO3- B. Ag+、NO3-、Cl-、Na+
C. Ca2+、Na+、Cl-、K+ D. Na+、H+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】没有水就没有生命,每人每天要补充2.5—4L水。下列关于水的说法不正确的是
A. 天然水都可以直接饮用
B. 夏天或发烧时,人体靠出汗来降低体温
C. 水是一种很好的溶剂
D. 符合生活饮用水卫生标准的水,可以安全饮用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为原子半径依次增大的四种短周期主族元素,其中元素a的最高正价与最低负价的代数和等于0,b、c能形成摩尔质量相同的两种单质,b、d则能化合成淡黄色的固体。下列有关判断不正确的是
A. 核电荷数大小:c>d>b>a
B. 简单氢化物的热稳定性:b>c
C. b能分别与a、c、d形成具有漂白性的物质
D. c与a形成的化合物分子中,各原子均达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,还可用于制取钾肥。某学习小组以钾长石为主要原料,从中提取氧化铝、碳酸钾等物质,工艺流程如下:
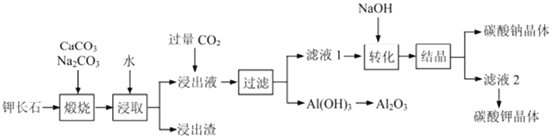
回答以下问题:
(1) 请以氧化物组成的形式表示钾长石的化学式为_____________
(2) 钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的KAlO2 和NaAlO2,写出Al2O3 转化为NaAlO2 的化学方程式_____________________。
(3) 已知“浸取”时应保持溶液呈碱性,分析其原因为____________(用离子方程式解释),若要提高浸取的速率,可采取的措施有_______________(回答一条)。
(4) 滤液1的主要成分是_________(填写化学式)
(5) 此工艺中可以循环利用的主要物质是________、___________和水。
(6) 以石墨为电极,通过电解Al2O3 可制得金属铝。电解池中接电源负极的一极的电极反应式是_______。长时间电解后,需要更换新的石墨电极的是___极(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的下列溶液 ①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4HCO3,其NH4+浓度由大到小的顺序是
A. ②③①④ B. ④①③②
C. ②①④③ D. ②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A. 电解池的阳极上发生氧化反应,阴极上发生还原反应
B. 原电池跟电解池连接后,电子从电池负极流向电解池阳极
C. 电镀时,电镀池里的阳极材料发生氧化反应
D. 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com