
���� ��1��Fe3+ˮ�����ɵ�Fe��OH��3��������������ˮ�е��������ʣ�����ˮ�����ã������豸�е�Fe���������ӷ�Ӧ�����������ӣ�
��2�����ݵ���غ㣺c��Cl-��=2c��Fe2+��+3c��Fe3+��+c��H+����������Һ��OH-Ũ�Ⱥ�С����������Ժ��Բ��ƣ����ݴ���Һ�������ӵ�Ũ�ȣ��ٸ���pH=-lgc��H+�����㣻
��3�������ӵ�ˮ���Ϊ������FeCl3����Һ�з�����ˮ�⣺������������ˮ����������������ӣ��ٽ�ˮ����ƽ��������У�ƽ�ⳣ������ʽ�й���ʹ�Һ�岻д�룻��һ��ˮ����ʾ���Ի����Ƶڶ���ˮ�⣮ˮ��̶�����������ˮ��ƽ�ⳣ����С��
��4����������ʹƽ�������ƶ���ˮ��Ϊ���ȷ�Ӧ�����Խ���ƽ�������ƶ�����ˮϡ�ͣ���ˮ��ƽ��Ҳ�����ƶ��������Ȼ�泥��Ȼ����ҺΪ���ԣ�������Ũ������ƽ�������ƶ�������̼�����ƣ������������ӣ�ƽ�������ƶ���
�ӷ�Ӧ�����ӷ���ʽ�п�֪�������ӵ�Ũ��Ӱ���Ũ�Ⱦۺ��Ȼ��������ɣ����Թؼ������ǵ�����Һ��pH��
��� �⣺��1��Fe3+ˮ�����ɵ�Fe��OH��3��������������ˮ�е��������ʣ�����ˮ�����ã���Ӧ�����ӷ���ʽΪ��Fe3++3H2O=Fe��OH��3�����壩+3H+��
�ʴ�Ϊ��Fe3+ˮ�����ɵ�Fe��OH��3��������������ˮ�е��������ʣ�Fe3++3H2O=Fe��OH��3�����壩+3H+��
��2�����ݵ���غ㣺c��Cl-��=2c��Fe2+��+3c��Fe3+��+c��H+����������Һ��OH-Ũ�Ⱥ�С����������Ժ��Բ��ƣ�����c��H+��=c��Cl-��-2c��Fe2+��-3c��Fe3+��=1.0��10-2mol•L-1������ҺpH=-lg1.0��10-2=2��
�ʴ�Ϊ��2��
��3��һ��ˮ�������ԣ�ˮ�����ɵ������ӻ����Ƶڶ���ˮ�⣬�ڶ������Ƶ�������K1��K2��K3��С��ϵ��K1��K2��K3��
�ʴ�Ϊ��K1��K2��K3��
��4����������ʹƽ�������ƶ���ʹƽ�������ƶ�����Ϊˮ��Ϊ���ȷ�Ӧ�����Խ��£�ƽ�������ƶ�����ˮϡ�ͣ���ˮ��ƽ��Ҳ�����ƶ��������Ȼ�泥��Ȼ����ҺΪ���ԣ�������Ũ������ƽ�������ƶ�������̼�����ƣ������������ӣ�����������Ũ�Ƚ��ͣ�ƽ�������ƶ�����ѡbd��
�ӷ�Ӧ�����ӷ���ʽ�п�֪�������ӵ�Ũ��Ӱ���Ũ�Ⱦۺ��Ȼ��������ɣ����Թؼ������ǵ�����Һ��pH��
�ʴ�Ϊ��bd��������Һ��pH��
���� ���⿼�����Ļ��������ʵ�Ӧ�á��������ʷ�����������ʵ���ƽ�ⳣ����С��ƽ���ƶ�Ӱ�����صȣ���Ҫѧ���߱���ʵ�Ļ�������������Ѷȣ��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
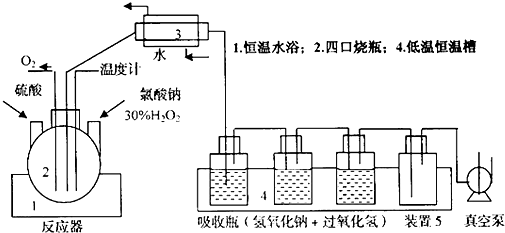
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | IBr�ĵ���ʽΪ  | |
| B�� | HClO�ĽṹʽΪH-O-Cl | |
| C�� | HIO��ԭ�Ӷ�����8���ӽṹ | |
| D�� | ���ۻ������ڲ������м��Լ��ͷǼ��Լ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��һ�������� | |
| B�� | �ҵ����ʵ���Ϊ0.05mol | |
| C�� | �����������ҵĿ��ܽṹ��3�֣�����˳���칹�� | |
| D�� | ������Ϊ2.4g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ��pH���� | B�� | пƬ���������� | ||
| C�� | ��Һ�е�SO42-Ũ������ | D�� | ��Һ���ܶ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �к͵ζ�ʵ���У�������װ��Һ�ĵζ���ϴ���������δ����ϴ���ⶨ���ƫ�� | |
| B�� | ʵ���ҴӺ�����ȡ���ʵ�ķ����ǣ�ȡ�������ա��ܽ�����ˡ���ȡ | |
| C�� | ֽ����ʵ������ѡ��ˮ���̶��࣬�л��ܼ��������࣬����ˮ��ǿ�ijɷ����������з������һЩ����ëϸ���������£����������ƶ����ٶȿ�һЩ | |
| D�� | �������ʼ�Ѫ�е���Ԫ��ʱ�����ڼ�Ѫ�м���ϡ���Ტ���Ƚ������ɵõ������ĩ��ȡ������ĩ���������軯��ϡ��Һ���ɵ���ɫ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | n=$\frac{{M}_{2}-2{M}_{1}}{58}$ | B�� | n=$\frac{{M}_{2}-{M}_{1}}{29}$ | C�� | n=$\frac{2{M}_{2}-{M}_{1}}{58}$ | D�� | n=$\frac{{M}_{2}-{M}_{1}}{58}$ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com