
【题目】
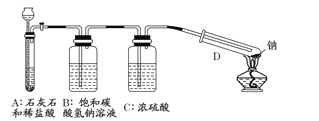
(1)该装置中饱和碳酸氢钠溶液的作用是 ,浓硫酸的作用是 。
(2)从试剂瓶中取出的金属钠,必须经过必要的操作,方可进行后续的实验,该必要的操作是 。
(3)放进试管中的金属钠在加热之前,必须进行的操作是 。
(4)用酒精灯在试管底部加热,钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟。试管底部有黑色物质生成。试管冷却后,试管壁上附着一层白色物质。往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现,则试管壁上附着的白色物质是 。然后将滤纸上的黑色物质移入小试管中,加少量浓硫酸,加热,产生有刺激性气味的二氧化硫气体和另一种无色常见气体。则该黑色物质与浓硫酸共热的化学反应方程式为 。
(5)据(4)中现象,试写出钠与二氧化碳反应的化学方程式: 。
【答案】(1)除去CO2中混有的HCl;干燥CO2气体(各2分,共4分)
(2)用滤纸吸干表面的煤油,并用小刀切去表层(2分)
(3)打开活塞,让产生的二氧化碳排尽试管内空气,并继续通入二氧化碳(2分)
(4)Na2CO3C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O(各2分)
CO2↑+2SO2↑+2H2O(各2分)
(5)4Na+3CO2![]() 2Na2CO3+C(2分)
2Na2CO3+C(2分)
【解析】试题分析:(1)要探究钠能否在二氧化碳中燃烧,首先要制取纯净的二氧化碳,装置A的作用是就是制取二氧化碳,盐酸具有挥发性,要想得到干燥、纯净的CO2,必须除去HCl和水蒸气,所以装置B中饱和碳酸氢钠溶液的作用是除去CO2中混有的HCl;浓硫酸的作用是干燥CO2气体。
(2)金属Na保存在煤油中,且表面有氧化膜,则从试剂瓶中取出金属钠后的操作是用滤纸吸干表面的煤油,并用小刀切去表层。
(3)在点燃酒精灯之前,必须除去系统内内的空气,防止钠与空气中的氧气反应,所以进行的操作是打开活塞,让产生的二氧化碳排尽试管内空气,并继续通入二氧化碳。
(4)钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟,该白色物质溶于水,再滴入稀盐酸,溶液中有气泡出现,说明有CO2生成,则试管壁上附着的白色物质是碳酸钠;碳可以和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+ 2H2O;
CO2↑+2SO2↑+ 2H2O;
(5)通过对生成物进行的探究实验可得出钠与二氧化碳反应生成了碳酸钠和碳,该反应的方程式为4Na + 3CO2 ![]() 2Na2CO3 + C。
2Na2CO3 + C。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】把2.1 g CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A.2.1 g B.3.6 g C.7.2 g D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C. 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)="0.24" mol
D. 该温度下此反应的平衡常数:K=1.44
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】坩埚是实验室用于灼烧或熔融固体物质的常用仪器,材质种类很多,实验时应根据物质的性质加以选择。实验室熔融碳酸钠时可以选用
A. 玻璃坩埚 B. 陶瓷坩埚
C. 石英坩埚 D. 铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯气的说法正确的是( )
A. 氯元素在自然界中既可以以化合态存在,也可以以游离态存在
B. 氯气是一种黄绿色、有毒的气体
C. 氯气不能溶于水,所以可用排水法收集氯气
D. 氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年7月21日,世界各国领导人在南非德班共同商讨应对气候变化的道路—“拯救人类的最后机会”。要想节能减排下列属最有希望的新能源是( )
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C为中学化学中常见的单质,在室温下A为固体,B和C为气体,向D溶液中加入KSCN溶液后,溶液显红色。在适宜的条件下可发生如下关系的化学反应。

回答以下问题:
(1) 在A、B、C三种元素中有一种金属元素,则这种元素是A、B、C中的 ,理由: 。
(2)写出 A、B、C 的名称:A 、B 、C 。
(3)写出E溶液+A→F溶液+C的化学反应方程式: 。
(4)写出除去D溶液中F杂质的离子反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液.其中可能含有Fe3+、Al3+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分:取此溶液分别进行了四个实验,其操作和有关现象如图所示:

第③个实验中,生成白色沉淀的量与加入NaOH的量有如下图所示的相互关系.

据此可知:
(1)在原溶液中一定存在的离子有_______________;
(2)写出第③个实验中发生反应的离子方程式___________________;
(3)写出第④个实验中生成气体的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
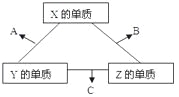
一个B分子中含有的Z原子个数比C分子少1个,B、C 两种分子中的电子数均等于10。
请回答下列问题:
(1)X元素在周期表中的位置是________________.
(2)B分子的电子式为________________。分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在_______________。
(3)已知Y+Z→C是一个可逆反应,其平衡常数表达式为_______________。有甲、乙两容器,容器容积固定,乙容器容积可变。一定温度下,在甲中加入2,molY、3molZ,反应达到平衡时生成C的物质的量为mmol。相同温度下,在乙中加入4 mol Y、6 mol Z,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成C的物质的量为________mol(从下列各项中选择,只填字母,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成C的物质的量为________mol。
A.小于m
B.等于m
C.在m~2m之间
D.等于2m
E.大于2m
(4)Y的最高价氧化物的水化物为W,其溶液呈黄色,其原因是________________(写化学方程式);W与C在适当条件下被W吸收生成一种盐Q,该盐的水溶液pH<7,其原因是(写出离子方程式)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com