
【题目】有一无色溶液.其中可能含有Fe3+、Al3+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分:取此溶液分别进行了四个实验,其操作和有关现象如图所示:

第③个实验中,生成白色沉淀的量与加入NaOH的量有如下图所示的相互关系.

据此可知:
(1)在原溶液中一定存在的离子有_______________;
(2)写出第③个实验中发生反应的离子方程式___________________;
(3)写出第④个实验中生成气体的化学方程式____________________。
【答案】(1)Al3+、Mg2+、K+、SO42-(2分)
(2)Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O(3分)
(3)2Na2O2+2H2O=4NaOH+O2↑(2分)
【解析】
试题分析:(1)溶液透过蓝色钴玻璃观察焰色反应为紫色,说明溶液中含有钾离子,溶液呈无色,说明一定不含有铁离子和铜离子。逐滴加入过量的氢氧化钠溶液有白色沉淀,则含有镁离子,一定不含碳酸根离子,加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有银离子,则生成硫酸钡沉淀,说明含有硫酸根离子。在第③个实验中生成白色沉淀的量与加入氢氧化钠的量想先增大后减小,说明溶液中还有铝离子。一定不含有铵根离子。综上所述,溶液一定有钾离子,硫酸根离子,镁离子,铝离子,一定不含有铁离子,铜离子,碳酸根离子。
(2)根据以上分析可知第③个实验中发生反应的离子方程式为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O。
(4)过氧化钠溶于水生成氧气,则第④个实验中生成气体的化学方程式2Na2O2+2H2O=4NaOH+O2↑。


科目:高中化学 来源: 题型:
【题目】除去下列物质中所含杂质(括号内为杂质),选用试剂及分离方法错误的是
A. CO2(SO2):饱和NaHCO3溶液,洗气
B. 乙醇(水):生石灰,蒸馏
C. MgCl2(AlCl3):过量NaOH溶液,过滤
D. Na2SO4溶液(Na2SO3):双氧水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
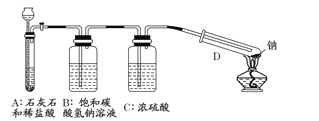
(1)该装置中饱和碳酸氢钠溶液的作用是 ,浓硫酸的作用是 。
(2)从试剂瓶中取出的金属钠,必须经过必要的操作,方可进行后续的实验,该必要的操作是 。
(3)放进试管中的金属钠在加热之前,必须进行的操作是 。
(4)用酒精灯在试管底部加热,钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟。试管底部有黑色物质生成。试管冷却后,试管壁上附着一层白色物质。往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现,则试管壁上附着的白色物质是 。然后将滤纸上的黑色物质移入小试管中,加少量浓硫酸,加热,产生有刺激性气味的二氧化硫气体和另一种无色常见气体。则该黑色物质与浓硫酸共热的化学反应方程式为 。
(5)据(4)中现象,试写出钠与二氧化碳反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时必须使用铁屑及6.00mol/L的硫酸,其他试剂任选。填写下列空白:

(1)B 中盛有一定量的NaOH溶液,A中应预先加入的试剂是___________,A中反应的离子方程式___________。
(2)实验开始时应先将活塞E_______________(城”打开”或“关闭”) ,其目的是_______________,在C中收集到的气体主要是_______________。
(3)简述生成Fe(0H)2的操作过程:_______________________。
(4)拔去装置B中的橡皮塞,让空气进入B中,可观察到的现象是_______________;写出有关反应的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述合理的是( )
A. 用干燥的pH试纸检测碳酸钠溶液、氯水、稀醋酸的pH值
B. 铜与浓硫酸反应时,可用蘸有浓溴水的棉花放在导管口吸收逸出的气体
C. 需用某浓度的NaOH溶液450 mL,则配制时应选用450 mL的容量瓶
D. 将液溴、浓硝酸保存在棕色试剂瓶中,放置于冷暗处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池的工作原理如右图所示,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-

下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质一定是MgCl2
B.负极反应式:ClO--2e-+H2O=Cl-+2OH-
C.电池工作时,OH-向b电极移动
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com