
 TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)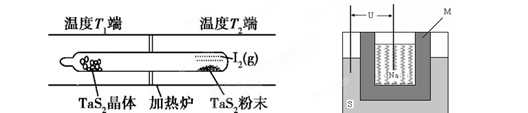
 HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-(2分,只写第一步也可得分)
H2S+OH-(2分,只写第一步也可得分) TaI4(g)+S2(g)
TaI4(g)+S2(g)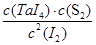 =4=
=4=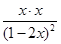
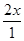 ×100%=80%
×100%=80% HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。

科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则: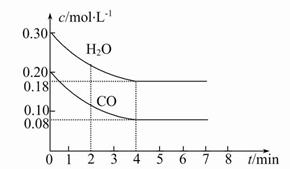
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
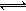 2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表:| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | | 0.4 |
| 15 | 0.8 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( )| A.c1 : c2=1 : 3 |
| B.平衡时,3VY (正) =2VZ (逆) |
| C.X、Y的转化率相等 |
| D.c1的取值范围为0.06<c1<0.16 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g) ΔH=—92.9kJ/mo1
CH3OH(g) ΔH=—92.9kJ/mo1| A.该反应的△S<0 |
| B.该反应在任何温度下均能自发进行 |
| C.向容器中充入少量He,平衡向正反应方向移动 |
| D.升高温度平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3
2SO3
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是
2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是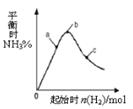
| A.反应在b点达到平衡 |
| B.b点H2的转化率最高 |
| C.c点N2的转化率最高 |
| D.a、b、c三点的平衡常数Kb > Ka > Kc |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
| B.常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小 |
| C.100 mL pH=3的HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA酸性比HB弱 |
D.已知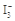  I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。| | A | B | C |
| Ⅰ | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
| Ⅱ | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
| Ⅲ | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
| Ⅳ | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com