
【题目】下列关于苯的叙述正确的是( )
A.从苯的结构简式![]() 看,苯分子中含有碳碳双键
看,苯分子中含有碳碳双键
B.苯的分子式为C6H6,它能使酸性KMnO4溶液褪色
C.![]() 的四氯代物有3种
的四氯代物有3种
D.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池的制造有不可磨灭的贡献,下列是以硫化锌精矿为原料制备单质锌的工业流程。
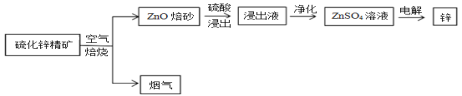
Ⅰ.(1)浸出液以硫酸锌为主,还含有 Fe3+、Fe2+、A13+、Cl-等杂质,会影响锌的电解,必须除去。净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为___。
②将浸出液的pH调节为5.5左右,使 Fe3+、A13+形成沉淀而除去,可选用的最佳试剂为___(填字母)
A.NaOH B.NH3·H2O C.Zn(OH)2 D.H2SO4
③用Ag2SO4可除去Cl-,发生反应的离子方程式为______。
④电解过程中析出锌的电极反应式为___。
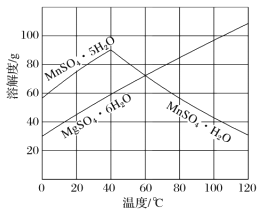
Ⅱ.烟气中的SO2可与软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液反应制备MnSO4·H2O。
(2)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10-39,pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(欲使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为___。
(3)由图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为___。
(4)锌锰碱性电池的总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,正极反应式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓄电池在放电和充电时分别起原电池和电解池的作用,某电池分别在放电和充电时发生的反应:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列对该电池的判断错误的是( )
Fe(OH)2+Ni(OH)2,下列对该电池的判断错误的是( )
A. 放电时,Fe是负极,NiO2是正极
B. 放电时电解质溶液中的阴离子向正极方向移动
C. 充电时阴极上的电极反应式为:Fe(OH)2+2e-=Fe+2OH-
D. 蓄电池的电极必须浸入碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有机物A有以下一系列反应,可以转化为F,
![]()
已知E的分子式为C2H6O2,B的分子结构分析,核磁共振氢谱图中有两个峰,而且峰的面积之比为3:2。回答下列问题:
(1)A→B的反应类型是____反应,E的官能团名称是____
(2)A的结构简式为______,D的系统命名为_______
(3)写出化学方程式
①D→E___________
②B→C __________
II.某有机物的蒸气密度是相同状态下甲烷密度的5.75倍,把1.84g该有机物在氧气中充分燃烧,将生成的气体混合物通过足量碱石灰,碱石灰增重4.08g,又知生成水和二氧化碳的物质的量之比为4:3,试求此有机物的分子式为_____,已知该有机物中只含一种官能团,且两个该官能团连在同一碳上的物质不稳定,则该有机物的结构简式为___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为原子序数依次增大的短周期元素,Y、W为同一周期元素且W原子的最外层电子数等于Y原子的核外电子总数,其形成的一种化合物结构如图所示,下列叙述正确的是
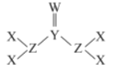
A.原子半径:W>Z>Y>X
B.该化合物中各元素的原子最外层均满足8电子结构
C.X与Y形成的二元化合物常温下一定为气态
D.X、Y、Z、W可形成原子个数比8:1:2:3的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
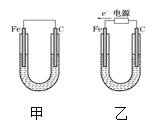
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的___棒,乙装置中的____棒;
②乙装置的电化学防护法称为____,其中碳极的电极反应式是:_____。
③取少量甲装置中负极附近溶液加入2滴K3[Fe(CN)6]溶液,现象为___,发生反应的离子方程式为________
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:______。
②甲装置碳极的电极反应属于_____(填“氧化反应”或“还原反应”);
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因_____
(3)用铂作电极电解饱和的下列物质的水溶液,一会儿后,向剩余电解液中加适量水,能使溶液和电解前相同的是(_____)
A.KI B.H2SO4 C.CuCl2 D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应为:4M + nO2 + 2nH2O = 4M(OH)n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是
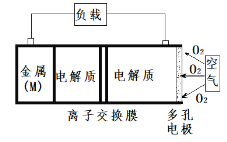
A.多孔电极有利于氧气扩散至电极表面,可提高反应速率
B.电池放电过程的正极反应式: O2 + 2H2O + 4e- = 4OH-
C.比较Mg、Al二种金属-空气电池,“理论比能量”之比是8∶9
D.为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空
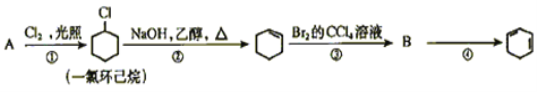
(1)A的名称是__________B的结构简式是_________
(2)②的反应类型是__________。③的反应类型是__________。
(3)反应④的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com