
【题目】在下列曲线中,纵坐标表示生成氢氧化铝的量,横坐标表示加入试剂的体积。从下边图中选出选项:
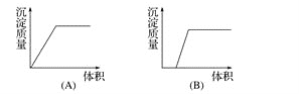

(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量__________。
(2)向氢氧化钠与偏铝酸钠混合液中通入二氧化碳过量__________。
(3)向氨水中逐滴滴入氯化铝溶液至过量__________。
(4)向氯化铝溶液中滴加氢氧化钠至过量__________。
(5)向偏铝酸钠溶液滴加盐酸至过量______________。
(6)向氯化镁和氯化铝混合液中加氢氧化钠至过量____________。
【答案】B B A C D E
【解析】
根据离子反应的实质与用量关系,结合图像进行分析。
(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量,先发生中和反应,NH3H2O+HCl=NH4Cl+H2O,无沉淀,后生成Al(OH)3沉淀且最终沉淀不溶解,反应方程式为AlCl3+3NH3H2O═Al(OH)3↓+3NH4Cl,与图像B吻合,故答案为B;
(2) 向NaOH与NaAlO2溶液中通入CO2气体:先发生2NaOH+CO2=2H2O+Na2CO3;后逐渐产生沉淀,NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,对照图象应为B;
(3) 氨水是弱碱,不能溶解氢氧化铝,向NH3H2O中逐滴滴入AlCl3溶液至过量:AlCl3+3NH3H2O═Al(OH)3↓+3NH4Cl,对照图象应为A;
(4) 向氯化铝溶液,加入氢氧化钠,先是氢氧化钠和氯化铝之间反应逐渐产生沉淀直到沉淀量最大,AlCl3+3NaOH═Al(OH)3↓+3NaCl,后是氢氧化铝溶解,Al(OH)3 +NaOH═NaAlO2+2H2O,对照图象应为C;
(5) 向偏铝酸钠溶液中加入稀盐酸:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,先产生沉淀,后沉淀溶解,所用稀盐酸溶液体积为1:3,对照图象应为D;
(6) MgCl2、AlCl3的混合液,逐滴加入NaOH溶液至过量,先是生成氢氧化镁和氢氧化铝沉淀,MgCl2+2NaOH═Mg(OH)2↓+2NaCl;AlCl3+3NaOH═Al(OH)3↓+3NaCl,后是氢氧化铝溶解,Al(OH)3+NaOH═NaAlO2+2H2O,对照图象应为E。


科目:高中化学 来源: 题型:
【题目】(1)写出符合要求的一个反应:
①吸热的分解反应的化学方程式:______________________。
②表示一类放热反应的离子方程式:____________________。
(2)化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知: N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;由N2和H2合成1 mol NH3时可放出46.2 kJ的热量。则N—H键的键能是_______。
(3)根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1;
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ·mol-1;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.5 kJ·mol-1。
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和![]() 、
、![]() 的混合气体,这些气体与
的混合气体,这些气体与![]() (标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入
(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入![]() 溶液至
溶液至![]() 恰好完全沉淀,则消耗
恰好完全沉淀,则消耗![]() 溶液的体积是( )
溶液的体积是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种常用的化肥,其工业生产流程如图,请回答下列问题。
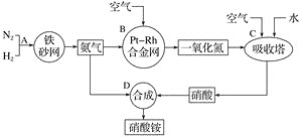
(1)写出反应容器B中发生反应的化学方程式:____。
(2)吸收塔C中通入空气的目的是___;C、D两个反应容器中发生的反应,属于氧化还原反应的是___(填反应容器代号)。
(3)浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:___。
(4)碳与浓硝酸反应的化学方程式是_____。
(5)将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况)。
①写出上述过程中,有关反应的离子方程式:____、____。
②完成该反应至少需要量取10mol·L-1的浓硝酸_____mL。
③混合气体中NO2的体积为____L,NO的体积为____L(均为标准状况下)。
④将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是( )
A.氯化铝溶液与过量氨水反应:3NH3H2O+Al3+=Al(OH)3↓+3NH4+
B.向氢氧化钠溶液中通入过量的CO2气体:CO2+2OH-=CO32-+H2O
C.FeCl3溶液与Cu粉反应:Cu+Fe3+=Cu2++Fe2+
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
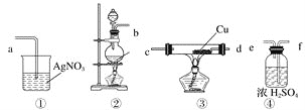
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g) N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4 和1.2mol NO2,测得不同温度下 n(CH4)随时间变化的有关实验数据如表所示,下列说法正确的是
组别 | 温度/K | 时间/min 物质的量/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | M | 0.15 |
A.由实验数据可知温度 T 1<T2
B.组别①中 0 ~20 min 内,NO2 降解速率为0.0125 molL-1min-1
C.40 min 时,表格中 M 对应的数据为 0.18
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有少量不与酸作用的可溶性杂质,试根据实验回答:
(1)准确称取4.0g烧碱样品。
(2)将样品配成250mL待测液。
(3)用____________(填仪器名称)量取25.00mL待测液于锥形瓶中,并滴加几滴甲基橙作指示剂。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时,两眼注视____________,直到滴定终点。达到终点的具体现象是:____________。
(5)若两次实验滴定的数据如下表:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 5.00 | 28.30 |
第三次 | 25.00 | 4.00 | 24.10 |
根据上述各数据,计算烧碱的纯度:____________
(6)下列操作中,会导致所测得的烧碱的纯度偏大的是________。
a.滴定终点时,俯视刻度
b.没有用盐酸标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
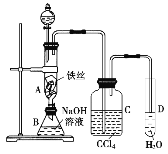
回答下列问题:
(1)写出A中发生主要反应的化学方程式___________________
(2)C中盛放CCl4的作用是_____________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,根据产生淡黄色沉淀,则能证明。你还能想出一种其他验证的方法吗?指出加入的试剂和出现的现象即可。
加入的试剂为________________
对应的现象为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com