
【题目】某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
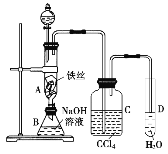
回答下列问题:
(1)写出A中发生主要反应的化学方程式___________________
(2)C中盛放CCl4的作用是_____________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,根据产生淡黄色沉淀,则能证明。你还能想出一种其他验证的方法吗?指出加入的试剂和出现的现象即可。
加入的试剂为________________
对应的现象为__________________。
【答案】![]() +Br2
+Br2 +HBr 除去溴化氢气体中的溴蒸气 除去溶于溴苯中的溴 紫色石蕊试液(或碳酸氢钠溶液)、 溶液变红色(或产生气泡)合理即可
+HBr 除去溴化氢气体中的溴蒸气 除去溶于溴苯中的溴 紫色石蕊试液(或碳酸氢钠溶液)、 溶液变红色(或产生气泡)合理即可
【解析】
苯与液溴在铁作催化剂的条件下发生反应生成溴苯,溴苯中混有的溴可以用氢氧化钠溶液来除去;溴化氢气体混合有的溴蒸气可以用四氯化碳来除去;氢溴酸溶液显酸性,含有溴离子,据此性质进行检验。
(1)苯与液溴发生反应的化学方程式为: ![]() +Br2
+Br2 +HBr;
+HBr;
答案是: ![]() +Br2
+Br2 +HBr;
+HBr;
(2) 要检验溴化氢的存在应先除去溴,溴易溶于四氯化碳,可以用四氯化碳除去溴化氢气体中的溴蒸气;
答案是: 除去溴化氢气体中的溴蒸气;
(3) 溴苯中含有杂质溴,溴与氢氧化钠反应,溴苯与氢氧化钠不反应,因此可以用氢氧化钠溶液除去溴苯中溶有的溴;
答案是:除去溶于溴苯中的溴;
(4)溴化氢的水溶液显酸性,能够使紫色石蕊试液变红,或与碳酸氢钠溶液反应产生无色气体;
故答案是:紫色石蕊试液(或碳酸氢钠溶液); 液变红色(或产生气泡)合理即可。


科目:高中化学 来源: 题型:
【题目】在下列曲线中,纵坐标表示生成氢氧化铝的量,横坐标表示加入试剂的体积。从下边图中选出选项:
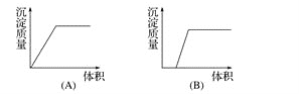

(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量__________。
(2)向氢氧化钠与偏铝酸钠混合液中通入二氧化碳过量__________。
(3)向氨水中逐滴滴入氯化铝溶液至过量__________。
(4)向氯化铝溶液中滴加氢氧化钠至过量__________。
(5)向偏铝酸钠溶液滴加盐酸至过量______________。
(6)向氯化镁和氯化铝混合液中加氢氧化钠至过量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市主要污染之一,治理的一种办法是在汽车排气管上装催化转化器,它使一氧化氮与一氧化碳反应生成可参与大气生态循环的无毒气体,并促使烃类充分燃烧及二氧化硫的转化,下列说法错误的是
A. 一氧化氮与一氧化碳反应的化学方程式为2CO+2NO![]() 2CO2+N2
2CO2+N2
B. 此方法的缺点是由于二氧化碳的增多,会大大提高空气的酸度
C. 为减少城市污染应开发新能源
D. 汽车尾气中有两种气体与血红蛋白结合而使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:
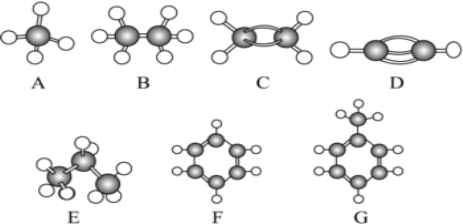
(1)常温下含氢量最高的烃是(填对应字母)________________;
(2)能够发生加成反应的烃有(填数字)________种;
(3)写出A失去一个氢原子形成的甲基的电子式______________________;
(4)F与浓硝酸和浓硫酸的混酸水浴加热生成的有机产物的名称为____________
(5)上述物质中互为同系物的是______________________或_______________(填对应字母)
(6)D与等物质的量溴反应的化学方程式为_________________所得产物的名称为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】内酯类化合物在农药、医药、纺织、印染及污染防治等领域具有广泛用途,如图为某内酯化合物G的一种常见合成路线:

回答下列问题:
(1)D生成E的反应类型为___;有机物1的结构简式为___。
(2)A生成B的化学方程式为___。F中含有的官能团的名称为___;E的结构简式为___。
(3)H是G的同分异构体,分子中含有一个六元环,且两个羧基连在同一个碳原子上。则H的结构共有___种,其中核磁共振氢谱有五组峰,且峰面积比为1:2:3:4:4的结构简式为___。
(4)请根据上述合成路线,设计以丙烯醛(CH2=CHCHO)和以上流程中的有机物1为原料,其他试剂任选,合成![]() 的路线___。
的路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )

A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,合理的说法是( )
2H2(g)+S2(g) ΔH>0,合理的说法是( )
A. 加入催化剂,反应途径将发生改变,ΔH也将随之改变
B. 升高温度,正逆反应速率都增大,H2S分解率也增大
C. 增大压强,平衡向逆反应方向移动,将引起体系温度降低
D. 若体系恒容,注入一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________,烧杯间填满碎塑料泡沫的作用是______.
(2)大烧杯上如不盖硬纸板,则求得的中和热数值______________(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,A(g)+B(g) ![]() C(g) ΔH<0,达到平衡后根据下列图象判断:
C(g) ΔH<0,达到平衡后根据下列图象判断:

(1)升高温度,达到新平衡的是________(填“A”、“B”、“C”、“D”、“E”,下同),新平衡中C的体积分数______(填“增大”、“减小”、“不变”,下同)。
(2)减小压强,达到新平衡的是________,A的转化率________。
(3)减小C的量,达到新平衡的是________。
(4)增加A的量,达到新平衡的是________,此时B的转化率________,A的转化率________。
(5)使用催化剂,达到新平衡的是________,C的质量分数________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com