
【题目】内酯类化合物在农药、医药、纺织、印染及污染防治等领域具有广泛用途,如图为某内酯化合物G的一种常见合成路线:

回答下列问题:
(1)D生成E的反应类型为___;有机物1的结构简式为___。
(2)A生成B的化学方程式为___。F中含有的官能团的名称为___;E的结构简式为___。
(3)H是G的同分异构体,分子中含有一个六元环,且两个羧基连在同一个碳原子上。则H的结构共有___种,其中核磁共振氢谱有五组峰,且峰面积比为1:2:3:4:4的结构简式为___。
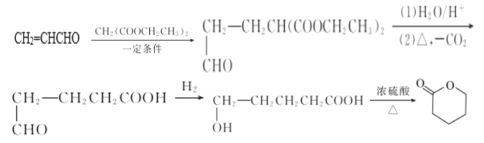
(4)请根据上述合成路线,设计以丙烯醛(CH2=CHCHO)和以上流程中的有机物1为原料,其他试剂任选,合成![]() 的路线___。
的路线___。
【答案】加成反应 CH2(COOCH2CH3)2 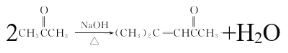 酯基、氰基
酯基、氰基 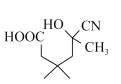 4
4 
【解析】
比较B、C的结构简式可知,有机物1的结构简式为:CH2(COOCH2CH3)2,比较D、E、F的结构简式可以推导出E的结构简式为: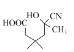 ,从而进行解答本题。
,从而进行解答本题。
(1)通过比较D和E的结构简式可知,D生成E是D与HCN发生加成反应生成E的,故其反应类型为加成反应,由分析可知有机物1的结构简式为CH2(COOCH2CH3)2,故答案为:加成反应 CH2(COOCH2CH3)2;
(2)通过比较A、B的结构简式可知由A生成B是两分子A发生反应,故其化学方程式为为: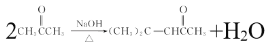 ,由F的结构简式可知其含有的官能团的名称为酯基和氰基,由分析可知E的结构简式为
,由F的结构简式可知其含有的官能团的名称为酯基和氰基,由分析可知E的结构简式为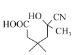 ,故答案为:
,故答案为: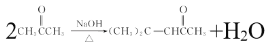 酯基和氰基
酯基和氰基  ;
;
(3)G的分子式为C9H14O4,其分子中含有一个六元环,且两个羧基连在同一个碳原子上,结构简式可以为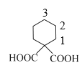 在1,2,3号位置上再与一个甲基相连,故有如图所示的3种,外加
在1,2,3号位置上再与一个甲基相连,故有如图所示的3种,外加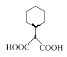 共4种,其中核磁共振氢谱有五组峰,且峰面积比为1:2:3:4:4的结构简式为
共4种,其中核磁共振氢谱有五组峰,且峰面积比为1:2:3:4:4的结构简式为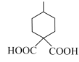 ,故答案为:4
,故答案为:4 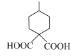
(4)![]() 可由HOOCCH2CH2CH2CH2OH通过分子内酯化反应得到,HOOCCH2CH2CH2CH2OH可由
可由HOOCCH2CH2CH2CH2OH通过分子内酯化反应得到,HOOCCH2CH2CH2CH2OH可由![]() 与H2加成得到,
与H2加成得到,![]() 又可以从题干流程图中C到D找到信息,由
又可以从题干流程图中C到D找到信息,由![]() 获得,在结合题干流程图B到C的信息,可以确定以丙烯醛(CH2=CHCHO)和以上流程中的有机物1为原料,其他试剂任选,合成
获得,在结合题干流程图B到C的信息,可以确定以丙烯醛(CH2=CHCHO)和以上流程中的有机物1为原料,其他试剂任选,合成![]() 的路线为:
的路线为: ,故答案为:
,故答案为: 。
。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是( )
A.氯化铝溶液与过量氨水反应:3NH3H2O+Al3+=Al(OH)3↓+3NH4+
B.向氢氧化钠溶液中通入过量的CO2气体:CO2+2OH-=CO32-+H2O
C.FeCl3溶液与Cu粉反应:Cu+Fe3+=Cu2++Fe2+
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:
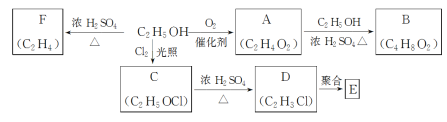
回答下列问题:
(1)C中的官能团名称是___。
(2)由乙醇生成F的化学方程式为____。
(3)由C生成D的反应类型为___,由乙醇生成A的反应类型为___。
(4)E是一种常见的塑料,其结构简式是___。
(5)由A生成B的化学反应方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研工作者发展了阴极还原电沉积制备高性能氧化铈电极材料的新方法。以石墨为电极,经历以下过程:①在电场的作用下,将电解液中的硝酸根离子插入石墨层间;②改变电流方向,已插入的和到达电极附近的NO3-放电,产生OH-和NO![]() ;③OH-与Ce3+结合形成氢氧化铈,氢氧化铈进一步失水氧化形成氧化铈(CeO2)。图示如图。已知298K时,Ksp[Ce(OH)3]=1×10-20,当离子浓度≤10-5mol·L-1时,可认为沉淀完全。下列说法错误的是( )
;③OH-与Ce3+结合形成氢氧化铈,氢氧化铈进一步失水氧化形成氧化铈(CeO2)。图示如图。已知298K时,Ksp[Ce(OH)3]=1×10-20,当离子浓度≤10-5mol·L-1时,可认为沉淀完全。下列说法错误的是( )
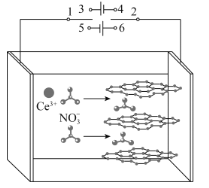
A.过程①,1接3,2接4;过程②,1接5,2接6
B.过程②,阴极电极反应为NO![]() +H2O+2e-=2OH-+NO
+H2O+2e-=2OH-+NO![]()
C.室温下,要保证电解液中Ce3+沉淀完全,阴极附近溶液的pH应不小于9
D.过程③,发生的反应为Ce3++3OH-=Ce(OH)3↓,4Ce(OH)3+O2=4CeO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工业的发展,酸雨已经称为全球性的环境问题。
(1)当雨水的pH___________,我们称它为酸雨。
(2)用化学方程式来表示酸雨形成的主要途径之一:_____________________,_______________。
(3)常温下测得某次酸雨样品的pH=5,该样品放置一段时间后,酸性略有增强,其原因可能是___________________________。
(4)写出一条减少二氧化硫排放的措施_________________________________。
(5)检验某无色溶液中是否存在SO42-的方法是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
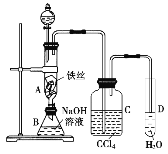
回答下列问题:
(1)写出A中发生主要反应的化学方程式___________________
(2)C中盛放CCl4的作用是_____________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,根据产生淡黄色沉淀,则能证明。你还能想出一种其他验证的方法吗?指出加入的试剂和出现的现象即可。
加入的试剂为________________
对应的现象为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.5mol A和2.5mol B混合盛入容积为2L的密闭容器里,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol·L-1·s-1,同时生成1mol D,下列叙述中错误的是
xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol·L-1·s-1,同时生成1mol D,下列叙述中错误的是
A. x=4
B. 达到平衡状态时容器内气体的压强与起始时压强比为6:5
C. 5s内B的反应速率V(B)=0.05mol·L-1·s-1
D. 达到平衡状态时A的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com