
【题目】随着工业的发展,酸雨已经称为全球性的环境问题。
(1)当雨水的pH___________,我们称它为酸雨。
(2)用化学方程式来表示酸雨形成的主要途径之一:_____________________,_______________。
(3)常温下测得某次酸雨样品的pH=5,该样品放置一段时间后,酸性略有增强,其原因可能是___________________________。
(4)写出一条减少二氧化硫排放的措施_________________________________。
(5)检验某无色溶液中是否存在SO42-的方法是_____________________________。
【答案】<5.6 SO2+H2O![]() H2SO3 2H2SO3+O2=2H2SO4 酸雨中的亚硫酸被氧化成硫酸了 燃料脱硫(合理即可) 取样于试管中,先滴加盐酸无现象,再滴加BaCl2溶液,出现白色沉淀,说明有SO42-,如无沉淀,则不存在SO42-
H2SO3 2H2SO3+O2=2H2SO4 酸雨中的亚硫酸被氧化成硫酸了 燃料脱硫(合理即可) 取样于试管中,先滴加盐酸无现象,再滴加BaCl2溶液,出现白色沉淀,说明有SO42-,如无沉淀,则不存在SO42-
【解析】
(1)雨水的pH< 5.6时称为酸雨,据此解答;
(2)酸雨形成的主要途径有两种,一种的雨水和二氧化硫反应生成亚硫酸,亚硫酸与空气中氧气反应生成硫酸,另一种途径为二氧化硫在空气中飘尘的作用下与氧气反应生成三氧化硫,三氧化硫与雨水反应生成硫酸,据此解答;
(3)亚硫酸酸性弱,而强酸酸性强,酸雨中的亚硫酸可能被氧化成硫酸,据此解答;
(4)减少二氧化硫排放的措施有用氨水吸收尾气,双碱脱硫,燃料脱硫等,据此解答;
(5)检验某无色溶液中是否存在SO![]() 的方法是取样于试管中,先滴加盐酸无现象,滴加盐酸主要目的是排出银离子、碳酸根、亚硫酸根等离子的干扰,再滴加BaCl2溶液,出现白色沉淀,说明有SO42-,如无沉淀,则不存在SO42-,据此解答;
的方法是取样于试管中,先滴加盐酸无现象,滴加盐酸主要目的是排出银离子、碳酸根、亚硫酸根等离子的干扰,再滴加BaCl2溶液,出现白色沉淀,说明有SO42-,如无沉淀,则不存在SO42-,据此解答;
(1)由于雨水中含有溶液的二氧化硫生成亚硫酸,因此当雨水的pH< 5.6,我们称它为酸雨,故答案为:<5.6;
(2)用化学方程式来表示酸雨形成的主要途径有两种,一种的雨水和二氧化硫反应生成亚硫酸,亚硫酸与空气中氧气反应生成硫酸,另一种途径为二氧化硫在空气中飘尘的作用下与氧气反应生成三氧化硫,三氧化硫与雨水反应生成硫酸,前者的反应方程式为SO2+H2O![]() H2SO3,2H2SO3 + O2 = 2H2SO4;
H2SO3,2H2SO3 + O2 = 2H2SO4;
(3)常温下测得某次酸雨样品的pH=5,该样品放置一段时间后,酸性略有增强,亚硫酸酸性弱,而强酸酸性强,其原因可能是酸雨中的亚硫酸被氧化成硫酸了;
(4)减少二氧化硫排放的措施有:用氨水吸收尾气,双碱脱硫,燃料脱硫等;
(5)检验某无色溶液中是否存在SO42-的方法是取样于试管中,先滴加盐酸无现象,滴加盐酸主要目的是排出银离子、碳酸根、亚硫酸根等离子的干扰,再滴加BaCl2溶液,出现白色沉淀,说明有SO42-,如无沉淀,则不存在SO42-。


科目:高中化学 来源: 题型:
【题目】某密闭容器中存在2NO+O2![]() 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是

A. 该反应的正反应是吸热反应。
B. 若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
C. T1时,当反应处于D点,则该反应的逆反应速率大于正反应速率。
D. 如果缩小容器体积,则平衡时表示NO转化率与温度变化关系的曲线在原曲线上方。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲的分子式为C4H9Br,在适宜的条件下能发生如下转化关系:
B![]() A
A![]() 甲(C4H9Br)
甲(C4H9Br)![]() D
D![]() E
E
已知:B能发生银镜反应,核磁共振氢谱显示其有三个吸收峰。试回答下列问题:
(1)甲的名称:____。甲生成A的反应类型是___。
(2)B与新制氢氧化铜悬浊液反应的化学方程式:____。
(3)甲与NaOH醇溶液共热的化学方程式为:___。
(4)A的同类同分异构体中,不能被催化氧化的物质的结构简式为___。
(5)D生成E的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮与氟、硫、镓三种元素之间可以形成具有特殊组成和性质的化合物。回答下列问题:
(1)基态镓原子电子排布式为___;硫原子核外有___种运动状态不同的电子。
(2)第一电离能符号为I1,I1(N)___I1(S)(填“>”或“<”)。
(3)NSF(N=S-F)与SNF(S=N-F)互为同分异构体。
①关于NSF与SNF的说法正确的是___ (填标号)。
A.二者均含有极性键和非极性键
B.二者均含有σ键与π键
C.二者均为非极性分子
D.二者与SO2均互为等电子体
②NSF发生聚合生成三聚分子A( ),SNF发生聚合生成三聚分子B(
),SNF发生聚合生成三聚分子B(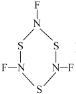 ),分子A中σ键与π键数目之比为___,分子B中氮原子价电子空间构型为___。
),分子A中σ键与π键数目之比为___,分子B中氮原子价电子空间构型为___。
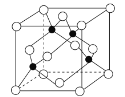
(4)氮化镓是直接隙半导体材料,具有易发光、电光转化效率高的特点。某种立方晶型氮化镓晶胞如图所示。(图中“O”与“●”大小比例关系符合二者原子实际大小比例关系)
①图中“●”表示的原子为___ (填元素符号)。
②已知NA为阿伏加德罗常数的值,晶胞的密度为dg·cm-3。则晶胞的边长为___ nm。两个距离最近的氮原子之间的距离为___ nm。(均用含d和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】内酯类化合物在农药、医药、纺织、印染及污染防治等领域具有广泛用途,如图为某内酯化合物G的一种常见合成路线:

回答下列问题:
(1)D生成E的反应类型为___;有机物1的结构简式为___。
(2)A生成B的化学方程式为___。F中含有的官能团的名称为___;E的结构简式为___。
(3)H是G的同分异构体,分子中含有一个六元环,且两个羧基连在同一个碳原子上。则H的结构共有___种,其中核磁共振氢谱有五组峰,且峰面积比为1:2:3:4:4的结构简式为___。
(4)请根据上述合成路线,设计以丙烯醛(CH2=CHCHO)和以上流程中的有机物1为原料,其他试剂任选,合成![]() 的路线___。
的路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:

(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________
(2)用饱和食盐水代替蒸馏水的目的是____________
(3)装置A的作用是_________,装置B中的现象是___________
(4)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为____________(用百分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol·(L·min) -1B. v (B)=0.2 mol·(L·min) -1
C. v (C)=0.3 mol·(L·min) -1D. v (D)=0.1 mol·(L·min) -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 mol·L-1的CH3COOH溶液中,当CH3COOH![]() H++CH3COO-已达平衡时,若要使CH3COOH的电离程度减小,溶液中的c(H+)增大,应加入( )
H++CH3COO-已达平衡时,若要使CH3COOH的电离程度减小,溶液中的c(H+)增大,应加入( )
A.CH3COONa固体B.氨水C.HClD.H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com