
����Ŀ���л���ķ���ʽΪC4H9Br�������˵��������ܷ�������ת����ϵ��
B![]() A
A![]() �ף�C4H9Br��
�ף�C4H9Br��![]() D
D![]() E
E
��֪��B�ܷ���������Ӧ���˴Ź���������ʾ�����������շ塣�Իش��������⣺
��1�������ƣ�____��������A�ķ�Ӧ������___��
��2��B������������ͭ����Һ��Ӧ�Ļ�ѧ����ʽ��____��
��3������NaOH����Һ���ȵĻ�ѧ����ʽΪ��___��
��4��A��ͬ��ͬ���칹���У����ܱ������������ʵĽṹ��ʽΪ___��
��5��D����E�Ļ�ѧ����ʽ��___��
���𰸡�2-��-1-����� ˮ�ⷴӦ��ȡ����Ӧ�� (CH3)2CHCHO+2Cu(OH)2+NaOH![]() (CH3)2CHCOONa+Cu2O��+3H2O (CH3)2CHCH2Br+NaOH
(CH3)2CHCOONa+Cu2O��+3H2O (CH3)2CHCH2Br+NaOH![]() (CH3)2C=CH2��+NaBr+H2O (CH3)3COH n CH2=C(CH3)2�� ��[-CH2-C(CH3)2-]��n
(CH3)2C=CH2��+NaBr+H2O (CH3)3COH n CH2=C(CH3)2�� ��[-CH2-C(CH3)2-]��n
��������
C4H9Br��NaOH��Һ���������·���ˮ������C4H9OH��C4H9OH��Cu�����������±���������C4H8O��C4H9Br��NaOH����Һ�����·�����ȥ��Ӧ����ϩ��C4H8��ϩ���ɷ����Ӿ۷�Ӧ���ݴ˻ش����⡣
��1��C4H9Br��NaOH��Һ���������·���ˮ������C4H9OH��C4H9OH��Cu�����������±���������C4H8O����C4H8O�ܷ���������Ӧ���˴Ź���������ʾ�����������շ壬˵����������ԭ�ӣ�����C4H8O�ĽṹʽΪ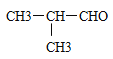 ����C4H9Br�ĽṹʽΪ��
����C4H9Br�ĽṹʽΪ��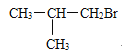 ������Ϊ2-��-1-����飻C4H9Br��NaOH����Һ�����·�����ȥ��Ӧ����ϩ��C4H8 ��
������Ϊ2-��-1-����飻C4H9Br��NaOH����Һ�����·�����ȥ��Ӧ����ϩ��C4H8 ��
��2��B������������ͭ����Һ��Ӧ����(CH3)2CHCOONa��������ͭ��ˮ���ʷ�Ӧ����ʽΪ��(CH3)2CHCHO+2Cu(OH)2+NaOH![]() (CH3)2CHCOONa+Cu2O��+3H2O��
(CH3)2CHCOONa+Cu2O��+3H2O��
��3��C4H9Br��NaOH����Һ�����·�����ȥ��Ӧ����ϩ��C4H8������ʽΪ��(CH3)2CHCH2Br+NaOH![]() (CH3)2C=CH2��+NaBr+H2O��
(CH3)2C=CH2��+NaBr+H2O��
��4��C4H9OH��ͬ���칹���У��ǻ�������̼ԭ����û����ԭ�ӣ����ܷ�������������Ϊ��(CH3)3COH��
��5��ϩ���ɷ����Ӿ۷�Ӧ������ʽΪ��n CH2=C(CH3)2�� ��[-CH2-C(CH3)2-]��n


 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MnO2��һ����Ҫ�������ϣ�ij���С�齫��MnO2��Ʒ�����н϶��MnO��MnCO3��ת��Ϊ��MnO2����ʵ�飬��������ͼ��ʾ������˵����ȷ���ǣ� ��
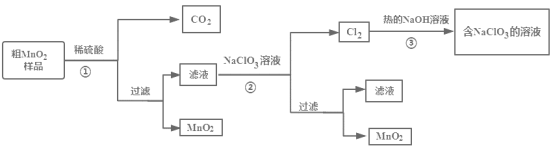
A.������м�ϡH2SO4����MnO2��Ʒ�е�MnO2��MnO��MnCO3��ת��Ϊ��������
B.����ڷ�Ӧ���ӷ���ʽΪ��5Mn2++2ClO3-+4H2O=5MnO2��+Cl2��+8H+
C.����۷�Ӧ��õ�����Һ��������Ҫ��NaClO3��NaOH
D.�������п���ѭ�����õ�����ֻ��NaClO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���NH3 ͨ��50 mL NH4Cl ��Һ����pH=10���������еμ�1 mol/L���ᡣ��Һ��pH�������������ı仯��ͼ��ʾ������˵������ȷ����
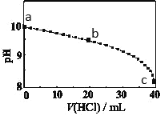
A.a ����Һ�У�c(OH-) = 1��10-4mol/LB.b ����Һ�У�c(![]() ) > c(Cl-)
) > c(Cl-)
C.a��b��ˮ�ĵ���̶ȼ�СD.c ��ʱ������� n(HCl)С��ͨ��� n(NH3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ���һ����Ҫ�Ļ���ԭ�ϣ����Ҵ�Ϊԭ���������IJ��ֻ�����Ʒ��ͼ��ʾ��
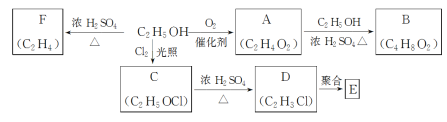
�ش��������⣺
��1��C�еĹ�����������___��
��2�����Ҵ�����F�Ļ�ѧ����ʽΪ____��
��3����C����D�ķ�Ӧ����Ϊ___�����Ҵ�����A�ķ�Ӧ����Ϊ___��
��4��E��һ�ֳ��������ϣ���ṹ��ʽ��___��
��5����A����B�Ļ�ѧ��Ӧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Mg��Cu��ɵĻ����26.4gͶ�뵽������ϡ�����У�������ȫ�ܽ⣬�ռ�����״���µ�NO����8.96L����Ӧ�����Һ�м��������5mol��L-1��NaOH��Һ300mL������������ȫ���������γɳ����������� ( )
A. 43.2gB. 46.8gC. 53.6gD. 63.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����й����߷�չ��������ԭ������Ʊ�������������缫���ϵ��·�������ʯīΪ�缫���������¹��̣����ڵ糡�������£������Һ�е���������Ӳ���ʯī��䣻�ڸı���������Ѳ���ĺ͵���缫������NO3-�ŵ磬����OH-��NO![]() ����OH-��Ce3+����γ��������棬���������һ��ʧˮ�����γ�������(CeO2)��ͼʾ��ͼ����֪298Kʱ��Ksp[Ce(OH)3]=1��10-20��������Ũ����10-5mol��L-1ʱ������Ϊ������ȫ������˵��������ǣ� ��
����OH-��Ce3+����γ��������棬���������һ��ʧˮ�����γ�������(CeO2)��ͼʾ��ͼ����֪298Kʱ��Ksp[Ce(OH)3]=1��10-20��������Ũ����10-5mol��L-1ʱ������Ϊ������ȫ������˵��������ǣ� ��
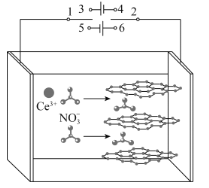
A.���̢٣�1��3��2��4�����̢ڣ�1��5��2��6
B.���̢ڣ������缫��ӦΪNO![]() +H2O+2e-=2OH-+NO
+H2O+2e-=2OH-+NO![]()
C.�����£�Ҫ��֤���Һ��Ce3+������ȫ������������Һ��pHӦ��С��9
D.���̢ۣ������ķ�ӦΪCe3++3OH-=Ce(OH)3����4Ce(OH)3+O2=4CeO2+6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ź�ҵ�ķ�չ�������Ѿ���Ϊȫ���ԵĻ������⡣
��1������ˮ��pH___________�����dz���Ϊ���ꡣ
��2���û�ѧ����ʽ����ʾ�����γɵ���Ҫ;��֮һ��_____________________��_______________��
��3�������²��ij��������Ʒ��pH=5������Ʒ����һ��ʱ�������������ǿ����ԭ�������___________________________��
��4��д��һ�����ٶ��������ŷŵĴ�ʩ_________________________________��
��5������ij��ɫ��Һ���Ƿ����SO42-�ķ�����_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��̬����������ܶȸߡ��ɱ��ͣ��乤��ԭ����ͼ��ʾ�����е缫 a���ò���ʯīϩ��S8���ϣ���ط�ӦΪ��16Li+xS8=8Li2Sx��2��x��8��������˵��������ǣ� ��

A. ��ع���ʱ�������ɷ�����Ӧ��2Li2S6+2Li++2e-=3Li2S4
B. ��ع���ʱ�����·������ 0.02 mol ���ӣ��������ϼ��� 0.14 g
C. ʯīϩ��������Ҫ����ߵ缫a�ĵ�����
D. ��س��ʱ��Խ���������Li2S2����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2����������һ�ֹ㷺ʹ�õ��л��ܼ����ϼ���Ҳ������������ֵ�Ѭ�������е�83.5 �棬�۵�35 �档ij�о���ѧϰС���ͬѧ������ͼ������װ��ʡ�ԣ�װ���Ʊ�һ������ 1��2�������飬�Ʊ�ԭ��Ϊ��C2H5OH![]() C2H4
C2H4![]() CH2ClCH2Cl��װ��A�е�Ũ�����Ǵ�������ˮ�����Ҵ����ܶ�ԼΪ0.8 g��mL1��
CH2ClCH2Cl��װ��A�е�Ũ�����Ǵ�������ˮ�����Ҵ����ܶ�ԼΪ0.8 g��mL1��
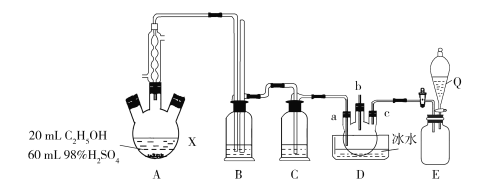
��1�������Ʊ�ԭ������֪װ��A�л�ȱ�ٵ�һ��ʵ��������_____��ʹ�������ܵ�Ŀ����_______��
��2��ʵ��ʱA��������ƿ���д̼�����ζ�������������Ϊ���շ�Ӧ�����ɵ������壬��װ��B��Ӧ����________������ĸ����
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
��3��D��a��c�������ܽ��������еij��Ȳ�ͬ�����ŵ���________���Ե���b�Ľ�һ������������_____________��װ��E������������ƿ����Q�е�������______________��
��4��д��D�з�Ӧ�Ļ�ѧ����ʽ________________________��
��5�����õ�a g 1��2-�������飬���Ҵ���������Ϊ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com