
【题目】将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
A. 43.2gB. 46.8gC. 53.6gD. 63.8g
【答案】B
【解析】
硝酸被还原为NO气体,且标准状况下体积为8.96L,即物质的量为0.4mol,根据氮元素的化合价变化计算转移电子物质的量。最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,故最后沉淀质量等于金属的质量加氢氧根离子的质量。
硝酸被还原为NO气体且标准状况下体积为8.96L,即物质的量为![]() =0.4mol,所以转移的电子的物质的量为0.4mol×(5-2)=1.2mol。
=0.4mol,所以转移的电子的物质的量为0.4mol×(5-2)=1.2mol。
最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,故最后沉淀质量等于26.4g+1.2mol×17g/mol=46.8g。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X原子的质量数为A,它与2H原子组成2HmX分子,此分子含N个中子,在a g 2HmX中所含电子的物质的量是
A. ![]() (A-N+m) molB.
(A-N+m) molB. ![]() (A-N) mol
(A-N) mol
C. ![]() (A-N+m) molD.
(A-N+m) molD. ![]() (A-N+2m) mol
(A-N+2m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
部分氢氧化物沉淀的pH如下表

沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH2 |
开始沉淀pH (离子初始浓度0.01 mol/L) | 4.3 | 2.3 | 10.4 |
完全沉淀pH (离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为_________。
(2)实验室进行步骤②的操作名称为________,其使用到的玻璃仪器是 。
(3)固体A的化学式为_______,物质C的化学式为_______;溶液中的Na+、Ca2+、Mg2+是在步骤________(填序号)中分离出去的。
(4)步骤③调节pH的数值范围为_______,步骤④调节pH的数值范围为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫黄在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,溴水褪色,乙变成丙。在丙里加入Na2S生成气体丁,把丁通入乙得到沉淀戊。甲、乙、丙、丁、戊均含有硫元素,则它们正确的顺序是
A. SO3、H2SO4、H2SO3、H2S、SB. SO2、H2SO3、H2SO4、SO2、SO3
C. SO3 、H2SO4、H2SO3、SO2、Na2S2O3D. SO2、H2SO3、H2SO4、H2S、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aM(g)+bN(g)![]() cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是

A. 同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B. 同压同z时,升高温度,平衡时Q的体积分数增加
C. 同温同z时,增加压强,平衡时Q的体积分数增加
D. 同温同压时,增加z,平衡时Q的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B+、C-、D、E、F2- 6种微粒(分子或离子),它们分别含10个电子,其中只有B+和F2-为单核微粒,且C-和E的组成元素相同,已知它们有如下转化关系:A++C-![]() D+E,据此回答下列问题:
D+E,据此回答下列问题:
(1)写出D的结构式___________,E的结构式___________。
(2)实验室制备D物质的反应方程式________。
(3)上述六种微粒中所含有的元素原子半径从大到小的顺序是__(用元素符号表示)。
(4)B、F两元素组成的原子数目比为1:1的化合物的电子式___________、该物质中存在的化学键有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如图所示。
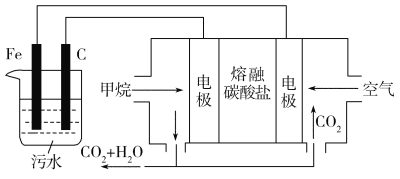
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4
b.CH3CH2OH
c.Na2SO4
d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e- = O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_______________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①负极的电极反应式为__________________________________________;
②正极的电极反应式为__________________________________________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用术语来描述,下列有关化学用语的使用正确的是( )
A. NH4Cl的电子式:![]() B. S2–的结构示意图:
B. S2–的结构示意图: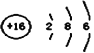
C. CO2的结构式:O=C=OD. 中子数为20的氯原子:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com