
【题目】MnO2是一种重要的无机材料,某设计小组将粗MnO2样品(含有较多的MnO和MnCO3)转化为纯MnO2进行实验,其流程如图所示,下列说法正确的是( )
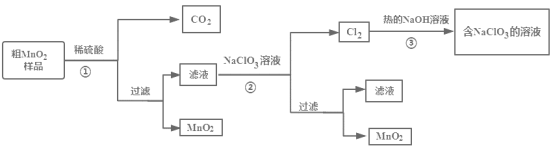
A.步骤①中加稀H2SO4,粗MnO2样品中的MnO2、MnO和MnCO3均转化为可溶物质
B.步骤②反应离子方程式为:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
C.步骤③反应后得到的溶液中溶质主要是NaClO3、NaOH
D.该流程中可以循环利用的物质只有NaClO3
【答案】B
【解析】
粗MnO2(含有较多的MnO和MnCO3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液Ⅰ为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液Ⅱ和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,
A. 第①步加入H2SO4时,MnO2不溶于硫酸,样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4 ,故A错误;
B. 由电子、电荷守恒可知,发生的离子反应为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+ ,故B正确;
C. 氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,故③反应后得到的溶液中溶质主要是NaClO3、NaOH、NaCl,故C错误;
D. 由工艺流程图可以看出,循环利用的是H2SO4和NaClO3,故D错误;
正确答案是B。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应,计算:
(1)Al的物质的量__________。
(2)参加反应的NaOH的物质的量__________和NaOH溶液的物质的量浓度___________。
(3)生成的H2在标准状况下的体积____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸(E)主要作为抗病毒和抗癌药物中间体, 作为合成治疗禽流感药物达菲(Tamiflu)的主要原料之一。其合成路线如下:

回答下列问题:
(1)A的化学名称是_____。D的分子式为_____。莽草酸(E)中含氧官能团的名称是_____。
(2)①的化学反应类型为_____。
(3)C与足量NaOH稀溶液反应的化学方程式为______。
(4)设计步骤②、③的目的是________。
(5) F是B的一种同分异构体,能与FeCl3溶液发生显色反应且核磁共振氢谱只有两组峰,则F的结构简式为____。
(6)有机材料G(属降冰片烯酸类,结构简式:![]() )用作医药中间体,依据题中合成路线设计以A(CH2=CH—COOH)和
)用作医药中间体,依据题中合成路线设计以A(CH2=CH—COOH)和![]() 为起始原料制备G的合成路线(无机试剂任选)______。
为起始原料制备G的合成路线(无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料,该电池工作原理如图。下列说法正确的是( )
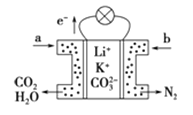
A.a为![]() ,b为
,b为![]()
B.在熔融电解质中,![]() 向正极移动
向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | t1 | t2 | t3 | t4 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
A.反应在前t1s 的平均速率v(O2) = 0.4/t1mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中存在2NO+O2![]() 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是

A. 该反应的正反应是吸热反应。
B. 若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
C. T1时,当反应处于D点,则该反应的逆反应速率大于正反应速率。
D. 如果缩小容器体积,则平衡时表示NO转化率与温度变化关系的曲线在原曲线上方。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫是硫的两种同素异形体。下列说法正确的是
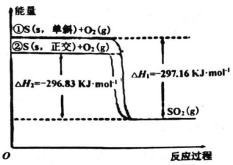
A.S(s,单斜)═S(s,正交) ΔH3=-0.33 kJmol1
B.单斜硫比正交硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂 1 mol O2 中的共价键所吸收的能量比形成 1 mol SO2 中的共价键所放出的能量多 297.16 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲的分子式为C4H9Br,在适宜的条件下能发生如下转化关系:
B![]() A
A![]() 甲(C4H9Br)
甲(C4H9Br)![]() D
D![]() E
E
已知:B能发生银镜反应,核磁共振氢谱显示其有三个吸收峰。试回答下列问题:
(1)甲的名称:____。甲生成A的反应类型是___。
(2)B与新制氢氧化铜悬浊液反应的化学方程式:____。
(3)甲与NaOH醇溶液共热的化学方程式为:___。
(4)A的同类同分异构体中,不能被催化氧化的物质的结构简式为___。
(5)D生成E的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com