
【题目】单斜硫和正交硫是硫的两种同素异形体。下列说法正确的是
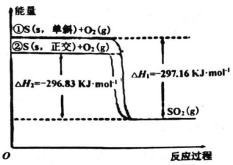
A.S(s,单斜)═S(s,正交) ΔH3=-0.33 kJmol1
B.单斜硫比正交硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂 1 mol O2 中的共价键所吸收的能量比形成 1 mol SO2 中的共价键所放出的能量多 297.16 kJ
【答案】A
【解析】
根据图示,已知:①S(s,单斜)+O2(g)=SO2(g) △H1=297.16 kJmol1;②S(s,正交)+O2(g)=SO2(g) △H2=296.83kJmol1;①②得到热化学方程式:S(s,单斜)=S(s,正交) △H3=0.33 kJmol1;
A. 根据盖斯定律得到热化学方程式为:S(s,单斜)=S(s,正交) △H3=0.33kJ·mol1,故A正确;
B. 依据热化学方程式,以及物质能量越低越稳定,正交硫能量低于单斜硫,所以正交硫稳定,故B错误;
C. 相同物质的量的正交硫比单斜硫所含有的能量低,故C错误;
D. ①式表示断裂lmolO2中共价键和断裂S(s,单斜)所吸收的总能量比形成1molSO2中共价键所放出的能量少297.16 kJ,故D错误;
答案选A。


科目:高中化学 来源: 题型:
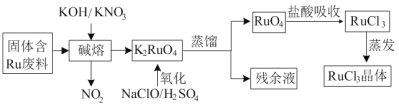
【题目】三氯化钌广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。现以固体含Ru废料为原料制备RuCl3晶体,其工艺流程如下:
回答下列问题:
(1)K2RuO4中Ru的化合价为_____,“碱熔”中产生的气体可用于____(写一种工业用途)。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,则需要氧化剂的物质的量为______mol。
(3)为了提高“碱熔”效率,可以采取的措施有______。
(4)RuO4气体有剧毒,“盐酸吸收”时的化学方程式为___________。
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2 = 2Ru+6HCl,所得实验数据记录如下:
实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.1875 | 2.0210 |
② | 5.1875 | 2.0190 |
③ | 5.1875 | 2.0200 |
④ | 5.1875 | 1.6200 |
则产品的纯度为________(用百分数表示)。
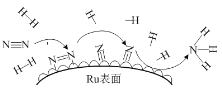
(6)钌及其化合物在合成工业上有广泛用途,根据图示写出合成反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机材料,某设计小组将粗MnO2样品(含有较多的MnO和MnCO3)转化为纯MnO2进行实验,其流程如图所示,下列说法正确的是( )
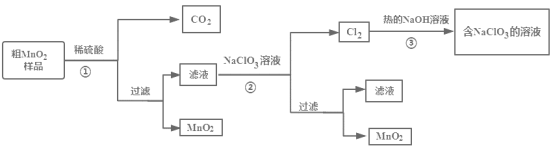
A.步骤①中加稀H2SO4,粗MnO2样品中的MnO2、MnO和MnCO3均转化为可溶物质
B.步骤②反应离子方程式为:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
C.步骤③反应后得到的溶液中溶质主要是NaClO3、NaOH
D.该流程中可以循环利用的物质只有NaClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是( )
A.氯化铝溶液与过量氨水反应:3NH3H2O+Al3+=Al(OH)3↓+3NH4+
B.向氢氧化钠溶液中通入过量的CO2气体:CO2+2OH-=CO32-+H2O
C.FeCl3溶液与Cu粉反应:Cu+Fe3+=Cu2++Fe2+
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g) N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4 和1.2mol NO2,测得不同温度下 n(CH4)随时间变化的有关实验数据如表所示,下列说法正确的是
组别 | 温度/K | 时间/min 物质的量/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | M | 0.15 |
A.由实验数据可知温度 T 1<T2
B.组别①中 0 ~20 min 内,NO2 降解速率为0.0125 molL-1min-1
C.40 min 时,表格中 M 对应的数据为 0.18
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NH3 通入50 mL NH4Cl 溶液中至pH=10,再向其中滴加1 mol/L盐酸。溶液的pH随加入盐酸体积的变化如图所示,下列说法不正确的是
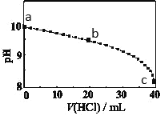
A.a 点溶液中,c(OH-) = 1×10-4mol/LB.b 点溶液中,c(![]() ) > c(Cl-)
) > c(Cl-)
C.a→b,水的电离程度减小D.c 点时,加入的 n(HCl)小于通入的 n(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:
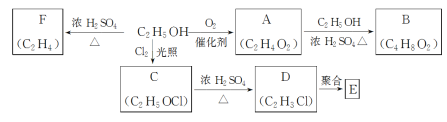
回答下列问题:
(1)C中的官能团名称是___。
(2)由乙醇生成F的化学方程式为____。
(3)由C生成D的反应类型为___,由乙醇生成A的反应类型为___。
(4)E是一种常见的塑料,其结构简式是___。
(5)由A生成B的化学反应方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com