
【题目】三氯化钌广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。现以固体含Ru废料为原料制备RuCl3晶体,其工艺流程如下:
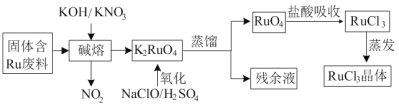
回答下列问题:
(1)K2RuO4中Ru的化合价为_____,“碱熔”中产生的气体可用于____(写一种工业用途)。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,则需要氧化剂的物质的量为______mol。
(3)为了提高“碱熔”效率,可以采取的措施有______。
(4)RuO4气体有剧毒,“盐酸吸收”时的化学方程式为___________。
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2 = 2Ru+6HCl,所得实验数据记录如下:
实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.1875 | 2.0210 |
② | 5.1875 | 2.0190 |
③ | 5.1875 | 2.0200 |
④ | 5.1875 | 1.6200 |
则产品的纯度为________(用百分数表示)。
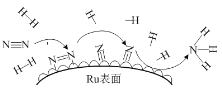
(6)钌及其化合物在合成工业上有广泛用途,根据图示写出合成反应的化学方程式________。
【答案】+6价 用来制取硝酸 2 适当升高温度、粉碎固体废料 2RuO4+16HCl = 2RuCl3+5Cl2↑+8H2O 80.00% N2+3H2![]() 2NH3
2NH3
【解析】
含Ru废料加入硝酸钾和氢氧化钾反应生成二氧化氮和K2RuO4,K2RuO4与NaClO、硫酸反应生成RuO4,RuO4与盐酸反应生成RuCl3、Cl2和H2O。
(1)根据K元素的化合价为+1价,O元素的化合价为2价分析得到K2RuO4中Ru的化合价为+6价,“碱熔”中产生的气体是二氧化氮,二氧化氮可用于制硝酸;故答案为:+6价;用来制取硝酸。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,根据得失电子守恒分析2mol K2RuO4氧化为RuO4失去4mol电子,NaClO中Cl元素的化合价由+1价降为-1价,1mol NaClO得到2mol电子,因此需要氧化剂的物质的量为2 mol;故答案为:2。
(3)为了提高“碱熔”效率,可以采取的措施有适当升高温度、粉碎固体废料;故答案为:适当升高温度、粉碎固体废料。
(4)RuO4气体有剧毒,根据图中信息用“盐酸吸收”时生成RuCl3,Ru化合价降低,则盐酸中氯元素的化合价升高变为氯气,其化学方程式为2RuO4+16HCl = 2RuCl3+5Cl2↑+8H2O;故答案为:2RuO4+16HCl = 2RuCl3+5Cl2↑+8H2O。
(5)根据数据得出第④实验数据误差较大,应舍弃,取另外三次的平均数据,得到Ru质量为2.0200g,产品中RuCl3的质量为![]() g,则产品的纯度为
g,则产品的纯度为![]() ;故答案为:80.00%。
;故答案为:80.00%。
(6)根据图中信息得到氮气和氢气在催化剂作用下反应生成氨气,其合成反应的化学方程式;N2+3H2![]() 2NH3;故答案为:N2+3H2
2NH3;故答案为:N2+3H2![]() 2NH3。
2NH3。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学用以下仪器组合的装置制取氯气,并探究其性质。
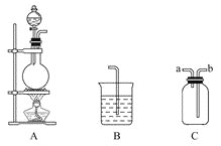
请回答下列问题:
(1)实验室制取氯气的化学方程式为___;检查图中反应器气密性的方法是___。
(2)现要求从图中选用所需的仪器(可重复选用)组成一套制取纯净、干燥氯气的装置,实验时要防止污染。下表是按仪器的连接顺序由上至下依次填写的,请将该表填写完整(加入的试剂自选)。______。
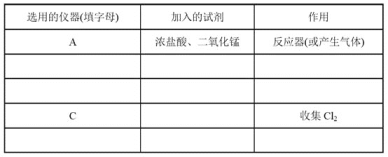
(3)该实验中用仪器C收集Cl2时,进气口应为___(填字母)。
(4)将氯气通入紫色石蕊试液中,可观察到溶液先变红后褪色的现象,出现这种现象的原因是___。
(5)人若吸入大量氯气会中毒死亡。某地化工厂的储氯罐意外发生泄漏,周围被疏散的群众应采取的自救措施是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知工业制氢气的反应为CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
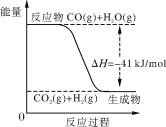
(1)增加H2O(g)的浓度,CO的转化率将________(填“增大”、“减小”或“不变”)。
(2)平衡常数的表达式K=________。400 ℃时平衡常数K______9(填“>”、“<” 或“=”)。
(3)已知2H2(g)+O2(g) ![]() 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:____。
2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计装置,进行实验探究KMnO4与浓盐酸的反应。
[实验1]设计如图1所示装置,并验证氯气的漂白性。
(1)高锰酸钾与浓盐酸的反应中,浓盐酸表现出的性质是_________;若实验中产生2.24 L(标准状况)Cl2,设NA为阿伏加德罗常数的值,则转移的电子数为___________。
(2)利用装置C验证氯气是否具有漂白性,则装置中I、II、III处依次放入的物质可能是__________________。
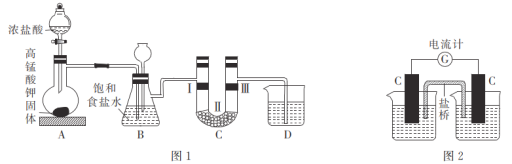
[实验2]设计如图2所示装置,左侧烧杯中加入100 mL由2.00 mol·L-1 KMnO4和6 mol·L-1 H2SO4组成的混合溶液,右侧烧杯中加入100 mL 5.00 mol·L-1 BaCl2溶液,盐桥选择KNO3琼脂。
(3)若用98%的浓硫酸(密度为1.84 g·cm-3)配制500 mL 6 mol·L-1的稀硫酸时,除了需用到玻璃棒、烧杯、量筒之外,还必须用到的玻璃仪器为____________;下列操作会导致所配溶液浓度偏小的是____________(填字母)。
A.容量瓶内壁附有水珠却未干燥处理 B.加水定容时俯视刻度线
C.颠倒摇匀后发现凹液面低于刻度线又加水补足 D.稀释过程中有少量液体溅出烧杯外
(4)左侧烧杯中石墨电极上的电极反应式为________________________________;盐桥中的K+移向____________ (填“左”或“右”)侧烧杯的溶液中。
(5)实验发现,其他条件不变,改用10.0 mol·L-1 H2SO4时,生成氯气的速率比使用6 mol·L-1 H2SO4时快且产生的气体体积更大,其可能的原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,下列物质相互转化如图所示:

试回答:
(1)写出B的化学式_______,D的化学式______。
(2)写出由E转变成F的化学方程式______。
(3)检验G溶液中阳离子的试剂为______,写出发生反应的离子方程式______。
(4)向G溶液加入A的有关离子反应方程式______。
(5)某同学取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,写出与上述变化过程相关的离子方程式______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应,计算:
(1)Al的物质的量__________。
(2)参加反应的NaOH的物质的量__________和NaOH溶液的物质的量浓度___________。
(3)生成的H2在标准状况下的体积____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸(E)主要作为抗病毒和抗癌药物中间体, 作为合成治疗禽流感药物达菲(Tamiflu)的主要原料之一。其合成路线如下:

回答下列问题:
(1)A的化学名称是_____。D的分子式为_____。莽草酸(E)中含氧官能团的名称是_____。
(2)①的化学反应类型为_____。
(3)C与足量NaOH稀溶液反应的化学方程式为______。
(4)设计步骤②、③的目的是________。
(5) F是B的一种同分异构体,能与FeCl3溶液发生显色反应且核磁共振氢谱只有两组峰,则F的结构简式为____。
(6)有机材料G(属降冰片烯酸类,结构简式:![]() )用作医药中间体,依据题中合成路线设计以A(CH2=CH—COOH)和
)用作医药中间体,依据题中合成路线设计以A(CH2=CH—COOH)和![]() 为起始原料制备G的合成路线(无机试剂任选)______。
为起始原料制备G的合成路线(无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫是硫的两种同素异形体。下列说法正确的是
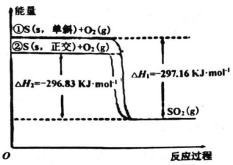
A.S(s,单斜)═S(s,正交) ΔH3=-0.33 kJmol1
B.单斜硫比正交硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂 1 mol O2 中的共价键所吸收的能量比形成 1 mol SO2 中的共价键所放出的能量多 297.16 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com