
【题目】某研究性学习小组的同学用以下仪器组合的装置制取氯气,并探究其性质。
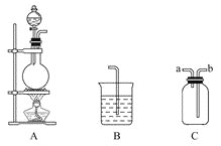
请回答下列问题:
(1)实验室制取氯气的化学方程式为___;检查图中反应器气密性的方法是___。
(2)现要求从图中选用所需的仪器(可重复选用)组成一套制取纯净、干燥氯气的装置,实验时要防止污染。下表是按仪器的连接顺序由上至下依次填写的,请将该表填写完整(加入的试剂自选)。______。
(3)该实验中用仪器C收集Cl2时,进气口应为___(填字母)。
(4)将氯气通入紫色石蕊试液中,可观察到溶液先变红后褪色的现象,出现这种现象的原因是___。
(5)人若吸入大量氯气会中毒死亡。某地化工厂的储氯罐意外发生泄漏,周围被疏散的群众应采取的自救措施是_______。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 关闭分液漏斗的活塞,末端连接导管,将导气管插入水中,用双手捂住烧瓶(或用酒精灯微热烧瓶),若导气管口有气泡冒出,松手后导气管中能形成一段稳定水柱,则说明气密性良好
MnCl2+Cl2↑+2H2O 关闭分液漏斗的活塞,末端连接导管,将导气管插入水中,用双手捂住烧瓶(或用酒精灯微热烧瓶),若导气管口有气泡冒出,松手后导气管中能形成一段稳定水柱,则说明气密性良好  b 氯气与水反应生成盐酸和次氯酸,盐酸能使石蕊试液变红,次氯酸能使石蕊试液褪色 先用水或弱碱性溶液将毛巾润湿后捂住口鼻,然后尽量沿逆风方向向地势较高处跑
b 氯气与水反应生成盐酸和次氯酸,盐酸能使石蕊试液变红,次氯酸能使石蕊试液褪色 先用水或弱碱性溶液将毛巾润湿后捂住口鼻,然后尽量沿逆风方向向地势较高处跑
【解析】
(1)实验室制备Cl2是用MnO2氧化浓盐酸,该装置的气密性检查应用加热法;
(2)由于MnO2与浓盐酸制得的Cl2中含有HCl、H2O,需除去,所以连接顺序为制气→除HCl→干燥→收集→尾气吸收,据此解答;
(3)由于Cl2密度大于空气,应用向上排空气法收集,应为长进短处;
(4) Cl2+H2O![]() HCl+HClO,HCl呈酸性,HClO具有漂白性,据此解答;
HCl+HClO,HCl呈酸性,HClO具有漂白性,据此解答;
(5)Cl2密度大于空气, 且Cl2与碱液反应,据此解答。
(1)实验室制备Cl2是用MnO2氧化浓盐酸,该装置的气密性检查应关闭分液漏斗的活塞,将导气管插入水中,用双手捂住烧瓶(或用酒精灯微热烧瓶),若导气管口有气泡冒出,松手后导气管中能形成一段稳定水柱,则说明气密性良好,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;关闭分液漏斗的活塞,将导气管插入水中,用双手捂住烧瓶(或用酒精灯微热烧瓶),若导气管口有气泡冒出,松手后导气管中能形成一段稳定水柱,则说明气密性良好;
MnCl2+Cl2↑+2H2O;关闭分液漏斗的活塞,将导气管插入水中,用双手捂住烧瓶(或用酒精灯微热烧瓶),若导气管口有气泡冒出,松手后导气管中能形成一段稳定水柱,则说明气密性良好;
(2)由于MnO2与浓盐酸制得的Cl2中含有HCl、H2O,需除去,所以连接顺序为制气→除HCl→干燥→收集→尾气吸收,仪器组合为A→C→C→C→B,对应的试剂和作用为:C;饱和氯化钠溶液;除去HCl;C;浓硫酸;除去H2O;B;NaOH溶液;吸收多余的Cl2;故答案为:C;饱和氯化钠溶液;除去HCl;C;浓硫酸;除去H2O;B;NaOH溶液;吸收多余的Cl2;
(3)由于Cl2密度大于空气,应用向上排空气法收集,则b管进气,a管出气,故答案为:b;
(4) 将氯气通入紫色石蕊试液中,可观察到溶液先变红后褪色的现象,是因为Cl2+H2O![]() HCl+HClO,溶液呈酸性,但是HClO具有强氧化性,能漂白指示剂,故答案为:氯气与水反应生成盐酸和次氯酸,盐酸能使石蕊试液变红,次氯酸能使石蕊试液褪色;
HCl+HClO,溶液呈酸性,但是HClO具有强氧化性,能漂白指示剂,故答案为:氯气与水反应生成盐酸和次氯酸,盐酸能使石蕊试液变红,次氯酸能使石蕊试液褪色;
(5)由于Cl2密度大于空气, Cl2与碱液反应,所以先用水或弱碱性溶液将毛巾润湿后捂住口鼻,然后尽量沿逆风方向向地势较高处跑,故答案为:先用水或弱碱性溶液将毛巾润湿后捂住口鼻,然后尽量沿逆风方向向地势较高处跑。


科目:高中化学 来源: 题型:
【题目】关于实验室制备乙烯的下列说法中,正确的是( )
①烧瓶中加入碎瓷片防止温度过高,受热均匀 ②烧瓶里注入酒精和浓硫酸(体积比1:3)混合均匀 ③温度计下端伸入液体内部,且不接触瓶底 ④加热时使温度缓慢上升至170度 ⑤加入的浓硫酸在反应中只起吸水剂的作用
A.①②B.④⑤C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
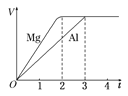
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图的所示的转化关系。由此推断:

(1)甲的化学式为_____________,丙的化学式为______________。
(2)写出甲和D反应的化学方程式___________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有_________________________。
A.稀硫酸 B.盐酸 C.硫氰化钾溶液 D.高锰酸钾溶液
(4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验:
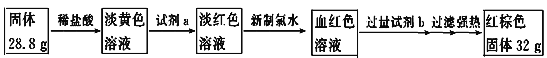
化合物甲的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(g) ![]() 2C(g),恒温恒压下,在密闭容器中充入1 mol A和2 mol B后的容积为3L。
2C(g),恒温恒压下,在密闭容器中充入1 mol A和2 mol B后的容积为3L。
(1)下列能用于判断该反应达到平衡的是(填字母):__________________。
a.A、B的浓度之比为1∶2 b.容器内气体的总物质的量不变
c.容器内气体密度不再变化 d.生成0.2 mol A的同时生成0.2 mol C
(2)平衡后,再向容器中通入1 mol氦气,A的转化率___________(填“增大”、“不变”、“减小”)。
(3)在T1、T2不同温度下,C的体积分数与时间关系如图所示。则T1 ______T2(填“大于”或“小于”,下同),该反应的△H __________0。若在T1下达到平衡,K(T1)=_____。(计算结果)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化钌广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。现以固体含Ru废料为原料制备RuCl3晶体,其工艺流程如下:
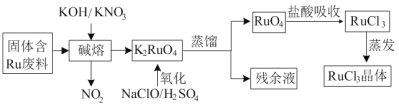
回答下列问题:
(1)K2RuO4中Ru的化合价为_____,“碱熔”中产生的气体可用于____(写一种工业用途)。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,则需要氧化剂的物质的量为______mol。
(3)为了提高“碱熔”效率,可以采取的措施有______。
(4)RuO4气体有剧毒,“盐酸吸收”时的化学方程式为___________。
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2 = 2Ru+6HCl,所得实验数据记录如下:
实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.1875 | 2.0210 |
② | 5.1875 | 2.0190 |
③ | 5.1875 | 2.0200 |
④ | 5.1875 | 1.6200 |
则产品的纯度为________(用百分数表示)。
(6)钌及其化合物在合成工业上有广泛用途,根据图示写出合成反应的化学方程式________。
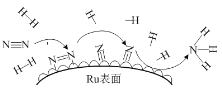
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com