
【题目】关于实验室制备乙烯的下列说法中,正确的是( )
①烧瓶中加入碎瓷片防止温度过高,受热均匀 ②烧瓶里注入酒精和浓硫酸(体积比1:3)混合均匀 ③温度计下端伸入液体内部,且不接触瓶底 ④加热时使温度缓慢上升至170度 ⑤加入的浓硫酸在反应中只起吸水剂的作用
A.①②B.④⑤C.②③D.③④
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】对二乙烯苯(![]() )可用作树脂、油漆及特种橡胶的原料下列说法正确的是
)可用作树脂、油漆及特种橡胶的原料下列说法正确的是
A.分子中所有原子可共平面B.一氯代物有4种(不考虑立体异构)
C.不能使酸性高锰酸钾溶液褪色D.1mol该分子最多可与2mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平。一段时间后能观察到铁钉生锈。下列说法不正确的是( )
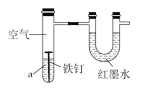
A. 铁钉表面发生的反应为Fe-3e-=Fe3+
B. 若液体a为稀醋酸,则U形管液面右高左低
C. 若液体a为食盐水,则U形管液面左高右低
D. 若液体a为食用油,则铁钉生锈速率较慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素的化学式为CO(NH2)2H2O2,是过氧化氢和尿素的加合物,外观为白色针状晶体,无毒无味,热分解温度为 45℃,易溶于水和乙醇,熔点 75-85℃,其水溶液兼有尿素和过氧化氢的性质,具有活性氧含量高、稳定性好等特点,被广泛用于医药、纺织领域。已知尿素与KMnO4溶液、NaOH 溶液都不反应。
I.合成过氧化尿素的流程及反应器的示意图如下:
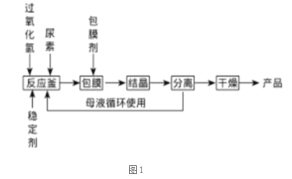
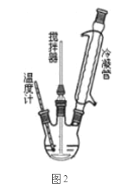
回答下列问题:
(1)图1中分离操作的名称为 _______,图 2 中反应器的名称是 _______;
(2)过氧化尿素是尿素分子与过氧化氢分子之间通过_________(填字母)结合形成的。
A.氢键 B.共价键 C.离子键 D.化学键
反应器中发生反应的化学方程式为____________。
(3)工业生产中,除向反应釜中投料反应物过氧化氢、工业尿素(含少量杂质铁、铜等离子)外,添加稳定剂可以提高产品的稳定性。不加稳定剂导致产品稳定率差的原因是 __。
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品 2.500g,溶解于水,在250mL 容量瓶中定容,准确量取其中 25.00mL 溶液于锥形瓶中,加入1mL6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2,三次滴定平均消耗KMnO4溶液 8.000mL。
①达到滴定终点的现象是____________。
②根据滴定结果确定产品质量_(填“合格”或“不合格”),活性氧的质量分数为___。
II.过氧化尿素的性质探究:
(5)过氧化尿素的催化分解实验:在试管中加入 0.1g 产品、少量水及二氧化锰,用火柴余烬检验生成气体,可观察到火柴复燃。实验中加入二氧化锰的量一定要少(固体控制在小米粒大小)的原因是:_________。
(6)测定过氧化尿素溶液的酸碱性:在试管中加入1mL 6mol/L NaOH溶液、1mL过氧化尿素溶液和 2mL无水乙醇,振荡试管。测得pH约为6,并观察到有白色的胶状沉淀生成,该沉淀为生成的NaHO2在乙醇中析出。写出该反应的化学方程式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
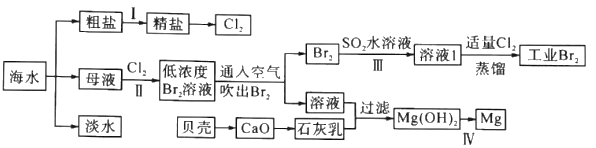
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是______(填字母)。
A.①②③④ B.②③④① C.②④③① D.③④②①
请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________、_________。
(2)步骤Ⅱ中已获得Br2,步骤Ⅲ中又将Br2还原为Br-,其目的是_________。步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2.可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A. ![]()
B.![]()
C.![]()
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油和煤都是重要的能源和化工原料,如图1是煤化工产业链的一部分。

试用所学知识,解决下列问题:
(1)柴油是由石油加工得到的重要产品,它在燃烧时往往冒黑烟,可能的原因是____。
(2)煤经过干馏可以得到焦炉气、煤焦油和焦炭等。煤焦油经过____(填加工方法)可得到芳香族化合物。
(3)煤的直接液化是煤和适当溶剂混合在高温和____存在下与____作用生成液态燃料的过程。
(4)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则X的化学式为____。
(5)工业上主要采用氨氧化法生产硝酸,如图2是氨氧化率与氨--空气混合气体中氧氨比的关系。其中直线表示反应的理论值;曲线表示实际生产情况。当氨氧化率达到100%,理论上γ[n(O2)/n(NH3)]=___,实际生产将γ维持在1.7~2.2之间,原因是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2的混合气体的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( )
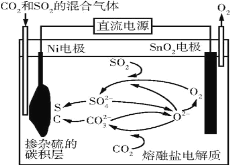
A.Ni电极表面发生了还原反应
B.阳极的电极反应为2O2--4e-=O2↑
C.电解质中发生的离子反应只有2SO2+O2+2O2-=2SO![]()
D.该过程实现了电解质中熔融碳酸盐和硫酸盐的自主补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体NH4I放入一个体积为VL的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)![]() NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g)![]() H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
A.平衡时氨气为2.5mol
B.平衡时HI的分解率为20%
C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol
D.其他条件不变把容器的体积缩小到V/2 L,重新达到平衡时H2的浓度是原平衡的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学用以下仪器组合的装置制取氯气,并探究其性质。
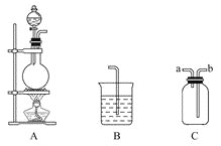
请回答下列问题:
(1)实验室制取氯气的化学方程式为___;检查图中反应器气密性的方法是___。
(2)现要求从图中选用所需的仪器(可重复选用)组成一套制取纯净、干燥氯气的装置,实验时要防止污染。下表是按仪器的连接顺序由上至下依次填写的,请将该表填写完整(加入的试剂自选)。______。
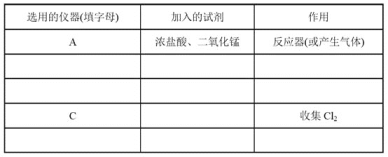
(3)该实验中用仪器C收集Cl2时,进气口应为___(填字母)。
(4)将氯气通入紫色石蕊试液中,可观察到溶液先变红后褪色的现象,出现这种现象的原因是___。
(5)人若吸入大量氯气会中毒死亡。某地化工厂的储氯罐意外发生泄漏,周围被疏散的群众应采取的自救措施是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com