
【题目】固体NH4I放入一个体积为VL的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)![]() NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g)![]() H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
A.平衡时氨气为2.5mol
B.平衡时HI的分解率为20%
C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol
D.其他条件不变把容器的体积缩小到V/2 L,重新达到平衡时H2的浓度是原平衡的2倍
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得。
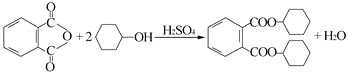
邻苯二甲酸酐 DCHP
下列说法正确的是
A.邻苯二甲酸酐的二氯代物有3种
B.环己醇分子中所有的原子可能共平面
C.DCHP能发生加成、取代、消去反应
D.1 mol DCHP最多可与含2 mol NaOH的溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验室制备乙烯的下列说法中,正确的是( )
①烧瓶中加入碎瓷片防止温度过高,受热均匀 ②烧瓶里注入酒精和浓硫酸(体积比1:3)混合均匀 ③温度计下端伸入液体内部,且不接触瓶底 ④加热时使温度缓慢上升至170度 ⑤加入的浓硫酸在反应中只起吸水剂的作用
A.①②B.④⑤C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2 ![]() 2NH3 的能量变化如图所示,该反应的热化学方程式是
2NH3 的能量变化如图所示,该反应的热化学方程式是
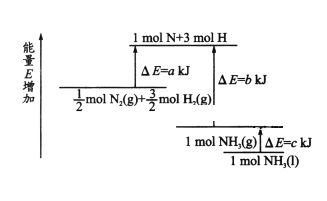
A. N2(g)+3H2(g)=2NH3(l) ![]() =2(a-b-c)kJ/mol
=2(a-b-c)kJ/mol
B. N2(g)+3H2(g)=2NH3(g) ![]() =2(b-c)kJ/mol
=2(b-c)kJ/mol
C. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(b+c-a)kJ/mol
=2(b+c-a)kJ/mol
D. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(a+b)kJ/mol
=2(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
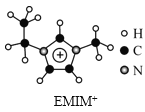
(1)碳原子价层电子的轨道表达式为__,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为__形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是__。NH3比PH3的沸点高,原因是__。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是__。
(4)EMIM+离子中,碳原子的杂化轨道类型为__。分子中的大π键可用符号Π![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π![]() ),则EMIM+离子中的大π键应表示为__。
),则EMIM+离子中的大π键应表示为__。
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于__晶体,其中硼原子的配位数为__。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为__(列出化简后的计算式)。
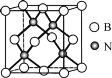
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
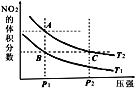
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(g) ![]() 2C(g),恒温恒压下,在密闭容器中充入1 mol A和2 mol B后的容积为3L。
2C(g),恒温恒压下,在密闭容器中充入1 mol A和2 mol B后的容积为3L。
(1)下列能用于判断该反应达到平衡的是(填字母):__________________。
a.A、B的浓度之比为1∶2 b.容器内气体的总物质的量不变
c.容器内气体密度不再变化 d.生成0.2 mol A的同时生成0.2 mol C
(2)平衡后,再向容器中通入1 mol氦气,A的转化率___________(填“增大”、“不变”、“减小”)。
(3)在T1、T2不同温度下,C的体积分数与时间关系如图所示。则T1 ______T2(填“大于”或“小于”,下同),该反应的△H __________0。若在T1下达到平衡,K(T1)=_____。(计算结果)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com