
【题目】化学反应N2+3H2 ![]() 2NH3 的能量变化如图所示,该反应的热化学方程式是
2NH3 的能量变化如图所示,该反应的热化学方程式是
A. N2(g)+3H2(g)=2NH3(l) ![]() =2(a-b-c)kJ/mol
=2(a-b-c)kJ/mol
B. N2(g)+3H2(g)=2NH3(g) ![]() =2(b-c)kJ/mol
=2(b-c)kJ/mol
C. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(b+c-a)kJ/mol
=2(b+c-a)kJ/mol
D. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(a+b)kJ/mol
=2(a+b)kJ/mol
【答案】A
【解析】
根据断键吸收的能量与成键释放的能量的相对大小,判断反应过程中的能量变化。
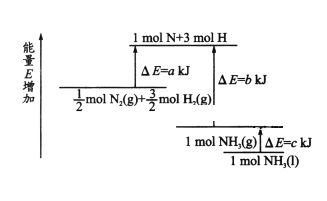
根据图像可知,反应物的总能量高于生成物的总能量,因此该反应是放热反应;由图知1/2molN2(g)和3/2molH2(g)形成1molN和3molH过程中吸收的能量为akJ,由1molN和3molH 结合生成1molNH3(g)释放的能量为bkJ,所以1/2N2(g)+3/2H2(g) =NH3(g)反应过程中△H=(a-b)kJ/mol;而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,故1/2N2(g)+3/2H2(g) =NH3(l) △H=(a-b-c)kJ/mol,也可以写成:N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1,故选A。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________反应(填“放热”或“吸热")。设CO2的初始浓度为comolL-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________(填“上方”或“下方”)。

(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/k.Jmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
则:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素的化学式为CO(NH2)2H2O2,是过氧化氢和尿素的加合物,外观为白色针状晶体,无毒无味,热分解温度为 45℃,易溶于水和乙醇,熔点 75-85℃,其水溶液兼有尿素和过氧化氢的性质,具有活性氧含量高、稳定性好等特点,被广泛用于医药、纺织领域。已知尿素与KMnO4溶液、NaOH 溶液都不反应。
I.合成过氧化尿素的流程及反应器的示意图如下:
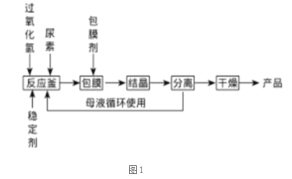
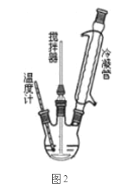
回答下列问题:
(1)图1中分离操作的名称为 _______,图 2 中反应器的名称是 _______;
(2)过氧化尿素是尿素分子与过氧化氢分子之间通过_________(填字母)结合形成的。
A.氢键 B.共价键 C.离子键 D.化学键
反应器中发生反应的化学方程式为____________。
(3)工业生产中,除向反应釜中投料反应物过氧化氢、工业尿素(含少量杂质铁、铜等离子)外,添加稳定剂可以提高产品的稳定性。不加稳定剂导致产品稳定率差的原因是 __。
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品 2.500g,溶解于水,在250mL 容量瓶中定容,准确量取其中 25.00mL 溶液于锥形瓶中,加入1mL6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2,三次滴定平均消耗KMnO4溶液 8.000mL。
①达到滴定终点的现象是____________。
②根据滴定结果确定产品质量_(填“合格”或“不合格”),活性氧的质量分数为___。
II.过氧化尿素的性质探究:
(5)过氧化尿素的催化分解实验:在试管中加入 0.1g 产品、少量水及二氧化锰,用火柴余烬检验生成气体,可观察到火柴复燃。实验中加入二氧化锰的量一定要少(固体控制在小米粒大小)的原因是:_________。
(6)测定过氧化尿素溶液的酸碱性:在试管中加入1mL 6mol/L NaOH溶液、1mL过氧化尿素溶液和 2mL无水乙醇,振荡试管。测得pH约为6,并观察到有白色的胶状沉淀生成,该沉淀为生成的NaHO2在乙醇中析出。写出该反应的化学方程式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油和煤都是重要的能源和化工原料,如图1是煤化工产业链的一部分。

试用所学知识,解决下列问题:
(1)柴油是由石油加工得到的重要产品,它在燃烧时往往冒黑烟,可能的原因是____。
(2)煤经过干馏可以得到焦炉气、煤焦油和焦炭等。煤焦油经过____(填加工方法)可得到芳香族化合物。
(3)煤的直接液化是煤和适当溶剂混合在高温和____存在下与____作用生成液态燃料的过程。
(4)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则X的化学式为____。
(5)工业上主要采用氨氧化法生产硝酸,如图2是氨氧化率与氨--空气混合气体中氧氨比的关系。其中直线表示反应的理论值;曲线表示实际生产情况。当氨氧化率达到100%,理论上γ[n(O2)/n(NH3)]=___,实际生产将γ维持在1.7~2.2之间,原因是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2的混合气体的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( )
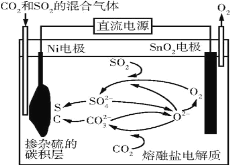
A.Ni电极表面发生了还原反应
B.阳极的电极反应为2O2--4e-=O2↑
C.电解质中发生的离子反应只有2SO2+O2+2O2-=2SO![]()
D.该过程实现了电解质中熔融碳酸盐和硫酸盐的自主补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO、NO2、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式__。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随![]() 的变化曲线如图1。
的变化曲线如图1。
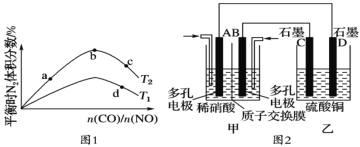
①a、b、c、d四点的平衡常数从大到小的顺序为__。
②若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为__,经过一段时间后,若乙中需加0.1molCu2(OH)2CO3可使溶液复原,则转移的电子数为__NA。
(4)常温下,SO2可以用碱溶液吸收处理。若将SO2通入到NaOH溶液中,充分反应后得到amol·L-1的NaHSO3溶液,该溶液的pH=5,则该溶液中c(SO32-)___c(H2SO3)(填“>”、“=”或“<”),HSO3-的电离常数约为___(用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体NH4I放入一个体积为VL的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)![]() NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g)![]() H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
A.平衡时氨气为2.5mol
B.平衡时HI的分解率为20%
C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol
D.其他条件不变把容器的体积缩小到V/2 L,重新达到平衡时H2的浓度是原平衡的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用制磷肥的副产物氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程如下:

(1)分解过程发生的反应为Na2SiF6+4NH3·H2O===2NaF+4NH4F+X↓+2H2O。工业上把滤渣X叫白炭黑,其化学式为__。
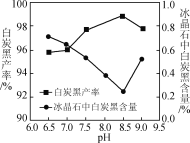
(2)分解时白炭黑产率和冰晶石纯度与pH的关系如图,分解时需要控制溶液的pH=______,能提高其分解速率的措施有____(填字母)。
A. 快速搅拌 B. 加热混合液至100 ℃ C. 减小氨水浓度
(3)流程中可循环利用的物质为_____;冰晶石在电解冶炼铝中的作用是_____。
(4)水浴加热过程中生成冰晶石的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com