
【题目】石油和煤都是重要的能源和化工原料,如图1是煤化工产业链的一部分。

试用所学知识,解决下列问题:
(1)柴油是由石油加工得到的重要产品,它在燃烧时往往冒黑烟,可能的原因是____。
(2)煤经过干馏可以得到焦炉气、煤焦油和焦炭等。煤焦油经过____(填加工方法)可得到芳香族化合物。
(3)煤的直接液化是煤和适当溶剂混合在高温和____存在下与____作用生成液态燃料的过程。
(4)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则X的化学式为____。
(5)工业上主要采用氨氧化法生产硝酸,如图2是氨氧化率与氨--空气混合气体中氧氨比的关系。其中直线表示反应的理论值;曲线表示实际生产情况。当氨氧化率达到100%,理论上γ[n(O2)/n(NH3)]=___,实际生产将γ维持在1.7~2.2之间,原因是____。

【答案】燃烧时氧气不充足 分馏 催化剂 水 Al(OH)3 1.25 O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%
【解析】
(1)如果燃烧时氧气不充足,会不完全燃烧,有碳颗粒生成,就会有黑烟产生,因此,本题正确答案是:燃烧时氧气不充足;
(2)从煤焦油中得到芳香族化合物常用分馏的方法制备,因此,本题正确答案是:分馏;
(3)煤的直接液化是煤与适当溶剂混合后在高温和催化剂存在下与和H2O作用生成液体燃料的过程,因此,本题正确答案是:催化剂;水;
(4)根据化学方程式: KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2和质量守恒定律分析,反应前K;1个,反应后:1个,则x中不含K;反应前Al:1个,反应后应:1个,则x中含有一个Al,依此类推,x中还含有3个O和3个H,则X的化学式为Al(OH)3 ,因此,本题正确答案是: Al(OH)3 ;
(5)由氨氧化的化学方程式:4NH3+5O2![]() 4NO+6H2O,可以知道氨氧化率达到100%,,理论上γ[n(O2)/n(NH3)]=5/4=1.25,因此,本题正确答案是:1.25;
4NO+6H2O,可以知道氨氧化率达到100%,,理论上γ[n(O2)/n(NH3)]=5/4=1.25,因此,本题正确答案是:1.25;
O2浓度太少不利于NH3的转化, γ[n(O2)/n(NH3)]值为2.2时NH3氧化率已近100%,因此,本题正确答案是: O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是


A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电化学的叙述正确的是( )
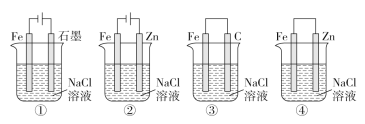
A. 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红
B. 图②装置中Fe电极参与反应发生腐蚀
C. 图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH-
D. 上述4个装置中,图①、②中Fe腐蚀速率较快,图③中Fe腐蚀速率较慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验室制备乙烯的下列说法中,正确的是( )
①烧瓶中加入碎瓷片防止温度过高,受热均匀 ②烧瓶里注入酒精和浓硫酸(体积比1:3)混合均匀 ③温度计下端伸入液体内部,且不接触瓶底 ④加热时使温度缓慢上升至170度 ⑤加入的浓硫酸在反应中只起吸水剂的作用
A.①②B.④⑤C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如右图所示。
根据题意完成下列填空:
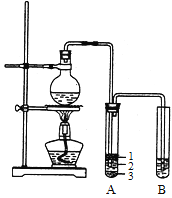
(1)圆底烧瓶中加入的反应物是溴化钠、_____和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为_________(选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式__________________________。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是_______________。试管A中的物质分为三层(如图所示),产物在第____层。
(4)试管A中除了产物和水之外,还可能存在_____、________(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是_____(选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是______________。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2 ![]() 2NH3 的能量变化如图所示,该反应的热化学方程式是
2NH3 的能量变化如图所示,该反应的热化学方程式是
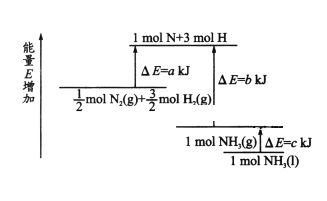
A. N2(g)+3H2(g)=2NH3(l) ![]() =2(a-b-c)kJ/mol
=2(a-b-c)kJ/mol
B. N2(g)+3H2(g)=2NH3(g) ![]() =2(b-c)kJ/mol
=2(b-c)kJ/mol
C. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(b+c-a)kJ/mol
=2(b+c-a)kJ/mol
D. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(a+b)kJ/mol
=2(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
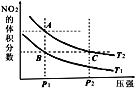
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图的所示的转化关系。由此推断:

(1)甲的化学式为_____________,丙的化学式为______________。
(2)写出甲和D反应的化学方程式___________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有_________________________。
A.稀硫酸 B.盐酸 C.硫氰化钾溶液 D.高锰酸钾溶液
(4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验:
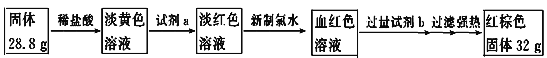
化合物甲的质量分数为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com