
【题目】实验室制取少量溴乙烷的装置如右图所示。
根据题意完成下列填空:
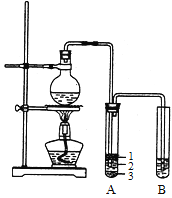
(1)圆底烧瓶中加入的反应物是溴化钠、_____和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为_________(选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式__________________________。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是_______________。试管A中的物质分为三层(如图所示),产物在第____层。
(4)试管A中除了产物和水之外,还可能存在_____、________(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是_____(选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是______________。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:_______________。
【答案】乙醇 b NaBr+H2SO4→HBr+NaHSO4 CH3CH2OH+HBr![]() CH3CH2Br+H2O 冷却、液封溴乙烷 3 HBr CH3CH2OH d 乙烯 反应会产生Br2,腐蚀橡胶
CH3CH2Br+H2O 冷却、液封溴乙烷 3 HBr CH3CH2OH d 乙烯 反应会产生Br2,腐蚀橡胶
【解析】
(1)制备溴乙烷需乙醇和溴化氢反应,故需要加乙醇;配制稀硫酸需要量筒来量所需浓硫酸的体积,故选b;
(2)溴化钠和浓硫酸反应先制得溴化氢,溴化氢再和乙醇反应生成溴乙烷;
(3)冰水将溴乙烷冷凝;
(4)还可能有挥发出来的溴化氢和乙醇;
(5)有机物呈棕黄色是因为溶有溴单质,有强氧化性,可以和亚硫酸钠反应而除去;氢氧化钠虽然和溴单质能反应,但和溴乙烷也发生反应,故选d;在浓硫酸做催化剂的作用下乙醇发生消去反应生成乙烯,注意名称应该写汉字;
(6)考虑橡胶管换成玻璃管,原因是溴腐蚀橡胶。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3,Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( )
A.0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-)
B.加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A)
C.加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A)
D.在滴定过程中,水的电离程度一直减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日,我国成功举办国庆七十周年阅兵活动。其中阅兵仪式上混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH= +206.0kJmol-1
(ii)合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH= -90.67kJmol-1
(1)制备合成气:工业生产中为解决合成气中H2过量而 CO 不足的问题,原料气中需添加CO2,发生的反应(iii):CO2(g)+H2(g) CO(g)+H2O(g) ΔH= +41.17kJmol-1,为了使合成气配比最佳,理论上原料气中二氧化碳与甲烷质量比为 _______。
(2)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①请写出二氧化碳加氢合成水蒸气和甲醇的热化学方程式____________。
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示:

a~d 点中反应一定处于平衡状态的点是____;CO2的转化率 a 点比 c 点高的原因是 ____。
③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:
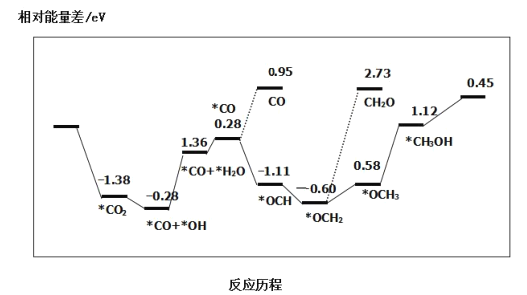
容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为___;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中____(填字母)的能量变化。
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3D.*OCH3→*CH3OH
(3)在一容积可变的密闭容器中充入10molCO和20molH2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①比较A、B 两点压强大小PA_______PB填“>、<、 =”)
②若达到化学平衡状态 A 时,容器的体积为 10 L,如果反应开始时仍充入 10molCO和20molH2,则在平衡状态 B 时,容器的体积V(B)=_______L;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丁烷在催化剂、加热、加压的条件下会以如下两种方式发生裂解:
①C4H10  CH4+C3H6
CH4+C3H6
②C4H10  C2H4+C2H6
C2H4+C2H6
现有1 mol丁烷,其中有36%以方式①裂解,有24%以方式②裂解,还有40%没有裂解,则最终所得混合气体的平均摩尔质量是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油和煤都是重要的能源和化工原料,如图1是煤化工产业链的一部分。

试用所学知识,解决下列问题:
(1)柴油是由石油加工得到的重要产品,它在燃烧时往往冒黑烟,可能的原因是____。
(2)煤经过干馏可以得到焦炉气、煤焦油和焦炭等。煤焦油经过____(填加工方法)可得到芳香族化合物。
(3)煤的直接液化是煤和适当溶剂混合在高温和____存在下与____作用生成液态燃料的过程。
(4)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则X的化学式为____。
(5)工业上主要采用氨氧化法生产硝酸,如图2是氨氧化率与氨--空气混合气体中氧氨比的关系。其中直线表示反应的理论值;曲线表示实际生产情况。当氨氧化率达到100%,理论上γ[n(O2)/n(NH3)]=___,实际生产将γ维持在1.7~2.2之间,原因是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】DCCNa (二氯异氰尿酸钠)固体是一种高效、安全的消毒剂。20℃以上易溶于水。(CNO)3H3 (氰尿酸)为三元弱酸。
I.制备DCCA (二氯异氰尿酸)装置如图。主要反应有:
碱溶 (CNO)3H3+ 2NaOH=(CNO)3Na2H + 2H2O △H<0
氯化 (CNO)3Na2H +2Cl2=(CNO)3Cl2H + 2NaCl H<0
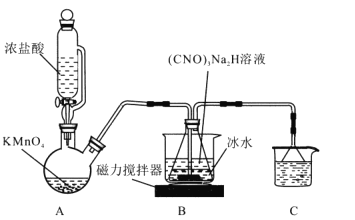
回答下列问题:
(1)装置C中的溶液是______________,作用为______________。
(2)装置A中反应的离子方程式为_______________。
(3)装置B用冰水浴的原因是__________, 碱溶时若氢氧化钠过量,(CNO)3Na2H中可能混有的杂质是__________。
Ⅱ.制备DCCNa
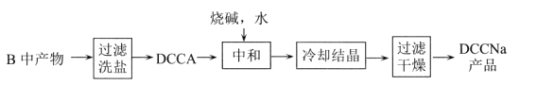
(4)步骤II中过滤洗盐”洗去的盐是__________________。
(5)“中和”反应的化学方程式为_________________。
(6)氧元素含量的测定:称取0. 1000 g DCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全邵转化成HClO,再加入足量的KI溶液,用淀粉作指示剂, 用01000 mol·L-1Na2S2O3标准溶液滴定生成的碘,消耗VmL.已知: I2+2S2O32-=2I-+S4O62-,样品中氯元素的质量分数=__________%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO、NO2、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式__。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随![]() 的变化曲线如图1。
的变化曲线如图1。
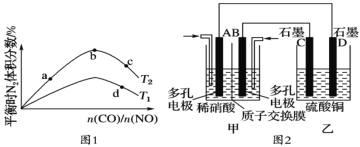
①a、b、c、d四点的平衡常数从大到小的顺序为__。
②若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为__,经过一段时间后,若乙中需加0.1molCu2(OH)2CO3可使溶液复原,则转移的电子数为__NA。
(4)常温下,SO2可以用碱溶液吸收处理。若将SO2通入到NaOH溶液中,充分反应后得到amol·L-1的NaHSO3溶液,该溶液的pH=5,则该溶液中c(SO32-)___c(H2SO3)(填“>”、“=”或“<”),HSO3-的电离常数约为___(用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能
有效抑制新型冠状病毒(2019-nCoV)的感染。
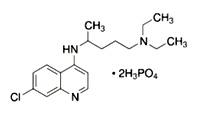
(1)已知磷酸氯喹的结构如图所示,则所含C、N、O三种元素第一电离能由大到小的顺序为_______________。P原子核外价层电子排布式为________,其核外电子有____个空间运动状态。
(2)磷酸氯喹中N原子的杂化方式为_________,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是_______________________。
(3)H3PO4中PO43- 的空间构型为________________。
(4)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ—V族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。
①磷化镓晶体中含有的化学键类型为__________(填选项字母)
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则原子2的分数坐标为______________。
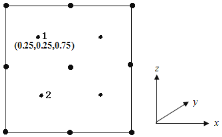
③若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com