
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
【答案】B
【解析】
试题A、当AB的浓度改变0.5 molL-1,由方程式A2(g)+B2(g)![]() 2AB(g)知,A2的浓度改变为0.25molL-1,所以a=(0.4-0.25)molL-1=0.15molL-1,即图中a点的值为0.15,故A正确;B、当AB的浓度改变0.5 molL-1,由方程式知,B2的浓度改变为0.25molL-1,所以平衡时B2的浓度为=(0.3-0.25)molL-1=0.05molL-1,K=
2AB(g)知,A2的浓度改变为0.25molL-1,所以a=(0.4-0.25)molL-1=0.15molL-1,即图中a点的值为0.15,故A正确;B、当AB的浓度改变0.5 molL-1,由方程式知,B2的浓度改变为0.25molL-1,所以平衡时B2的浓度为=(0.3-0.25)molL-1=0.05molL-1,K=![]() =
=![]() =
=![]() ,故B错误;C、已知A2(g)+B2(g)2AB(g)释放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小,故C正确;D、当AB的浓度改变0.5 molL-1,由方程式知,A2的浓度改变为0.25molL-1,已知A2的初始量为0.4molL-1,所以平衡时A2的转化率为
,故B错误;C、已知A2(g)+B2(g)2AB(g)释放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小,故C正确;D、当AB的浓度改变0.5 molL-1,由方程式知,A2的浓度改变为0.25molL-1,已知A2的初始量为0.4molL-1,所以平衡时A2的转化率为![]() ×100%=62.5%,故D正确;故选B。
×100%=62.5%,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下:

某化学兴趣小组同学模拟该流程设计了如下实验装置:

回答下列问题:
(1)a处可用来检验I中的反应是否发生,选用的试剂是______________,若要停止I中的化学反应,除停止加热外,还要采取的操作是________________________。
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O ②可能是CuO;③可能是CuS;④_______。乙同学提出假设①一定不成立,该同学的依据是______;丙同学做了如下实验来验证黑色物质的组成:

基于上述假设分析,黑色物质的组成为__________________________(填化学式)。
(3)II中发生反应的化学方程式为_____________________,实验中通入的SO2不能过量,可能的原因是______________________。
(4)为检验制得的硫代硫酸钠产品的纯度,该小组称取5.0g产品配成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:向锥形瓶中加入25.00mL 0.01mol·L-1的KIO3溶液,再加入过量的KI溶液并酸化,发生反应的离子方程式为___________,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应I2 + 2S2O32- == 2I- + S4O62-,当达到滴定终点时,消耗Na2S2O3溶液20.00mL,则该产品的纯度是____________(保留3个有效数字)。
(5)丁同学提出上述实验装置的设计存在不足,建议在I上__________;在I、II之间增加_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在紫外线的作用下,氧气可生成臭氧:3O2![]() 2O3,一定条件下该反应达到平衡状态的标志是( )
2O3,一定条件下该反应达到平衡状态的标志是( )
A. 单位时间内生成2 mol O3,同时消耗3 mol O2
B. O2的消耗速率0.3 mol·L-1·s-1,O3的消耗速率0.2 mol·L-1·s-1
C. 容器内,2种气体O3、O2浓度相等
D. 气体密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明某溶液中不含Fe3+而可能含有Fe2+的实验操作如下:①加入足量新制氯水,②加入足量酸性高锰酸钾溶液,③加入少量硫氰化铵溶液,④加入氢氧化钠溶液。最佳的实验操作及顺序是( )
A.①③B.③②C.③①D.④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有50 mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,实验测得加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如下图所示。下列叙述正确的是

A. HA溶液的物质的量浓度为0.01 mol·L-1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离常数K约为1.25×10-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列实验装置进行的相应实验,错误的是( )
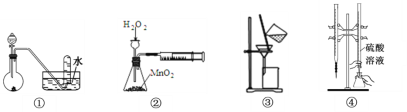
A. 用①图装置,进行H2O2分解制取少量O2的实验
B. 用②图装置,进行测定H2O2的分解速率的实验
C. 用③图装置,进行分离Fe(OH)3胶体和NaCl溶液的实验
D. 用④图装置,进行用已知浓度的硫酸溶液测定NaOH溶液浓度的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
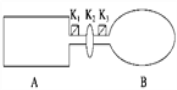
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com