
����Ŀ��A���ɵ��Ȳ����Ƴɵ��ܱ�������B��һ�ͻ�ѧ��ʴ�����ڴ��ȵ����ر�K2����������������NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱ��A��B�������ͬ��(��֪��2NO2(g) ![]() N2O4(g)����H��0)
N2O4(g)����H��0)
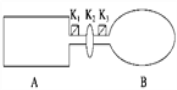
��1��һ��ʱ���Ӧ�ﵽƽ�⣬��ʱA��B������N2O4��������vA______vB(������������������������)��������K2������B��______(���������������С������������)��
��2���رջ���K2������A��B���ٳ������ʼ����ȵ�NO2����ﵽƽ��ʱ��NO2��ת������A��________(����������������С������������)�����ֱ�ͨ���������������ﵽƽ��ʱ��A��NO2��ת���ʽ�________��B��NO2��ת���ʽ�______(���������������С������������)��
��3�������£���A��B������������䣬��A����һ�����Ȳ㣬B�������Խ����ȴ��ݣ���ﵽƽ��ʱ��______�е���ɫ���
��4����������A�г���4.6 g��NO2���ﵽƽ��������ڻ�������ƽ����Է�������Ϊ57.5����ƽ��ʱN2O4�����ʵ���Ϊ___________________��
���𰸡� �� ��С ���� ���� ��С A 0.02mol
�������������������1������װ�ÿ�֪��A�DZ��ֺ��º��ݵģ�B�DZ��ֱ��ֺ��º�ѹ�ġ����ڸ÷�Ӧ�������С�ķ��ȵĿ��淴Ӧ������A�е�ѹǿ�ڷ�Ӧ�����м�С������A�еķ�Ӧ����С��B�еķ�Ӧ���ʡ�������K2�����൱������װ���Ǻ��º�ѹ�ģ���������B����С����2���ڼ��������NO2���壬��A���൱������ѹǿ��ƽ��������Ӧ�����ƶ���ת����������ͨ�������Ne������A�����ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���ת���ʲ��䣻��B��ѹǿ����ģ����������ݻ��������ʵ�Ũ�ȼ�С��ƽ�����淴Ӧ������У�ת���ʼ�С����3���÷�ӦΪ���ȷ�Ӧ����A�����������Ȳ㣬�൱�ڸ�A���ȣ�ƽ�������ƶ���NO2��Ũ������A�е���ɫ���
��4��4��6g��NO2�����ʵ���Ϊ0��1mol,n(��)=4��6/57��6=0��08mol,��������ʽ���⣺
2NO2![]() N2O4
N2O4
��ʼ 0��1 0
�仯 2x x
ƽ��0��1-2x x 0��1-2x+x=0��08 x=0��02mol



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3.2gCu�������8mol/L 30mLHNO3��Ӧ������Ļ�ԭ����ΪNO2��NO����Ӧ����������Һ��n(H+)Ϊamol������Һ������n(NO3-)Ϊ����
A. amol B. (0.1+a)mol C. (0.05+a)mol D. (0.2+a)mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.4mol��L-1HA��Һ��0.2mol��L-1NaOH��Һ�������ϣ���û����Һ��c(Na+)��c(A-),��
��1�������Һ��c(A-)_________c(HA)(�������������=��)
��2�������Һ��c(HA)+ c(A-)__________0.2mol��L-1(�������������=��)
��3��25��ʱ�����ȡ0.4 mol��L-1HA��Һ��0.2mol��L-1NaOH��Һ�������ϣ�����û����Һ��pH=8����c(Na+)-c(A-)=___________������ȷ��ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ƵĻ�ѧ���ʺͻ�ѧ��Ӧ�����෨�����ü�����������ģ�
��1����������5�����ʣ�CuO��CO��MgO��Na2O��FeO�����ղ�ͬ�ķ��������������1������������4�����������ԵIJ�ͬ���ҳ��������ʣ���д�����ݣ�д�����֣���
����
�� ��
��2����Ȼ����ķ�����ͬ�������ӷ�Ӧ��������ԭ��Ӧ֮��Ҳ������һ���Ĺ�ϵ���ü�ͼʾ������ʾ����֮��Ĺ�ϵ ��
��3�������е�ʳ�Ͷ����ֱ����ڷ�ɢϵ�е��� �� �����Լ����ѧר�����ʣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������ʹ���������Һ��c(Cl-)=c(CH3COO-),����������ȷ����
A. �øô����������������ʵ�飬����ĵ��ݸ�����
B. ��ˮϡ����ͬ�����������Һ��pHС������
C. �ֱ���ˮϡ����ͬ������������Һ��:c(Cl-)=c(CH3COO-)
D. ������Һ��pH��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe3O4�ɱ�ʾΪFeOFe2O3 �� ��һ���������������ʹ��Բ��ϣ�ˮ�ȷ��Ʊ�Fe3O4���������ķ�ӦΪ3Fe2++2S2O32��+O2+xOH��=Fe3O4+S4O62��+yH2O������˵���У�����ȷ���ǣ� ��
A.ÿ����1mol Fe3O4 �� ��Ӧת�Ƶĵ�������Ϊ4mol
B.�÷�Ӧ�У��������뻹ԭ�����ʵ���֮��Ϊ1��5
C.3mol Fe2+������ʱ������O2��״���µ����ԼΪ22.4L
D.x=4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ�ζ���ȷ��ȡ25.00mLijδ֪Ũ�ȵ�������һ�ྻ����ƿ�У�Ȼ����0.20mol��L-1������������Һ��ָʾ��Ϊ��̪���ζ����ζ�������£�
ʵ���� | NaOH��ʼ���� | NaOH�յ���� |
��һ�� | 0.10mL | 18.40mL |
�ڶ��� | 3.00mL | 21.10mL |
������ | 0.20mL | 20.40mL |
���Ĵ� | 0.00mL | 18.20mL |
��1���ζ�����ʹ��֮ǰ��Ҫ��_________����ϴ�Ӻ���ϴ
��2���жϵζ��յ��������____________________________________��
��3�������������ݿ��Լ������������ʵ���Ũ��Ϊ__________mol��L-1(С���������λ��Ч����)��
��4�����²���������ɲⶨ���ƫ�ߵ���_________����д��ţ���
A.�ζ�ǰ����ʽ�ζ��ܼ������ݣ��ζ�����ʧ
B.�ζ�ǰ������ȷ���ﵽ�ζ��յ���Ӷ���
C.�ζ����յ����ʱ���ֵζ��ܼ����һ����Һ
D.ʢװδ֪Һ����ƿ������ˮϴ��δ�ô���Һ��ϴ
E��δ��������Һ��ϴ��ȡ����ʽ�ζ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����û�ѧƽ���ƶ�ԭ�����͵�����������
A. �������Ƶ���ˮʱ����Һ��pH��С
B. ��ҵ�����У�500�����ұȳ����¸������ںϳɰ�
C. ����Ũ��ˮ���������ƹ��������ȡ����
D. ����ѹǿ��������SO2��O2��Ӧ����SO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com