
【题目】将0.4mol·L-1HA溶液与0.2mol·L-1NaOH溶液等体积混合,测得混合溶液中c(Na+)﹥c(A-),则:
(1)混合溶液中c(A-)_________c(HA)(填“﹥”“﹤”或“=”)
(2)混合溶液中c(HA)+ c(A-)__________0.2mol·L-1(填“﹥”“﹤”或“=”)
(3)25℃时,如果取0.4 mol·L-1HA溶液与0.2mol·L-1NaOH溶液等体积混合,若测得混合溶液的pH=8,则c(Na+)-c(A-)=___________。(填准确数值)
【答案】 < = 9.9×10-7 mol·L-1
【解析】试题分析:本题考查溶液中粒子浓度的大小关系。将0.4mol·L-1HA溶液与0.2mol·L-1NaOH溶液等体积混合,反应后得到物质的量浓度均为0.1mol/L的HA和NaA的混合溶液,由于c(Na+)![]() c(A-),说明HA为弱酸,且混合液中HA的电离程度
c(A-),说明HA为弱酸,且混合液中HA的电离程度![]() A-的水解程度,溶液中粒子浓度由大到小的顺序为c(HA)
A-的水解程度,溶液中粒子浓度由大到小的顺序为c(HA)![]() (Na+)
(Na+)![]() c(A-)
c(A-)![]() c(OH-)
c(OH-)![]() c(H+)。
c(H+)。
(1)根据上述分析,c(A-)![]() c(HA)。
c(HA)。
(2)根据物料守恒,混合溶液中c(HA)+c(A-)=0.2mol/L。
(3)溶液中的电荷守恒为:c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)-c(A-)=c(OH-)-c(H+)=1![]() 10-6mol/L-1
10-6mol/L-1![]() 10-8mol/L=9.9
10-8mol/L=9.9![]() 10-7mol/L。
10-7mol/L。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大(注CxHy为可燃烧的有机物)。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示,则下列说法不正确的是

A.空/燃比的增大使氧气的浓度增大,因而CO、CxHy的含量会慢慢变小
B.当空/燃比达到15后由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,故NOx减少
C.空/燃比的增大,燃烧产生的高温及火花塞放电能促使空气中的氮气与氧气直接生成NO2
D.在机动车尾气出口处使用催化剂能将CO、NOx转化为无害的N2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一次实验开放日活动中,某同学取出一无色溶液,向其中滴加酚酞试液后变成红色。该同学作出的下列结论中正确的是( )
A.该溶液能使石蕊试液变成蓝色B.该溶液的pH小于7
C.该溶液一定是碱溶液D.该溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的叙述正确的是( )
A. 陶瓷、玻璃、水泥都是硅酸盐产品
B. 水晶、玛瑙、光纤、硅胶的主要成分都是SiO2
C. SiO2很稳定,与所有的酸都不反应
D. 单质硅是制作光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院研究人员开发研制出一种石墨烯锂硫电池,其工作原理:2Li+S8=Li2S8如图所示,下列有关该电池说法正确的是

A. b电极发生还原反应
B. a电极上发生的一个电极反应为:2Li++S8-2e-=Li2S8
C. 电池工作时,外电路中流过0.01mol电子,负极材料质量减重0.069g
D. 电子从b电极经过外电路流向a电极,再经过电解质流回b电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示. 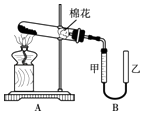
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 .
②据报道高锰酸钾受热分解不产生MnO2 , 已知产气率= ![]() ×100%.若只发生KMnO4
×100%.若只发生KMnO4 ![]() KMnO2+O2↑,则产气率为 .
KMnO2+O2↑,则产气率为 .
③XRD谱显示还会分解产生K2MnO4和K2Mn4O8 , 写出分解产生这两种物质及氧气的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题: 
(1)分类标准代号A表示(可多项)
a.两物质都是非电解质b.两物质都易溶于水
c.两物质都是含碳化合物d.两物质都是氧化物
(2)上述五种物质中的某一物质的饱和溶液中通入足量CO2 , 溶液中会有晶体析出.该反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
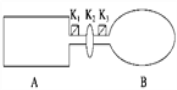
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色.
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO; ③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O
(2)上述实验过程②与③中,I2起到了的作用.
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:(填化学式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com