
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
实验编号 | NaOH起始读数 | NaOH终点读数 |
第一次 | 0.10mL | 18.40mL |
第二次 | 3.00mL | 21.10mL |
第三次 | 0.20mL | 20.40mL |
第四次 | 0.00mL | 18.20mL |
(1)滴定管在使用之前需要先_________,再洗涤和润洗
(2)判断滴定终点的现象是____________________________________。
(3)根据以上数据可以计算出盐酸的物质的量浓度为__________mol·L-1(小数点后保留两位有效数字)。
(4)以下操作可能造成测定结果偏高的是_________(填写序号)。
A.滴定前,碱式滴定管尖有气泡,滴定后消失
B.滴定前读数正确,达到滴定终点后,俯视读数
C.滴定到终点读数时发现滴定管尖处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用盐酸溶液润洗量取用酸式滴定管
【答案】 查漏 溶液由无色变粉红色且半分钟不变色 0.15 AC
【解析】试题分析:本题考查酸碱中和滴定的实验、数据处理和误差分析。
(1)滴定管在使用之前需要先查漏,再洗涤和润洗。
(2)由于盐酸在锥形瓶中,用酚酞作指示剂,所以滴定终点的现象是:溶液由无色变粉红色且半分钟内不变色。
(3)第一次实验消耗NaOH溶液的体积为18.40mL-0.10mL=18.30mL,第二次实验消耗NaOH溶液的体积为21.10mL-3.00mL=18.10mL,第三次实验消耗NaOH溶液的体积为20.40mL-0.20mL=20.20mL,第四次实验消耗NaOH溶液的体积为18.20mL-0.00mL=18.20mL,由于第三次实验有明显误差,将第三次实验数据舍弃,实验中消耗NaOH溶液体积的平均值为![]() =18.20mL,c(HCl)V[HCl(aq)]=c(NaOH)V[NaOH(aq)],c(HCl)=
=18.20mL,c(HCl)V[HCl(aq)]=c(NaOH)V[NaOH(aq)],c(HCl)=![]() =0.15mol/L。
=0.15mol/L。
(4)根据公式c(HCl)=![]() 分析。A项,滴定前,碱式滴定管尖有气泡,滴定后消失,所耗NaOH溶液体积偏大,测定结果偏高;B项,滴定前读数正确,达到滴定终点后,俯视读数,所耗NaOH溶液体积偏小,测定结果偏低;C项,滴定到终点读数时发现滴定管尖处悬挂一滴溶液,所耗NaOH溶液体积偏大,测定结果偏高;D项,盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗,对测定结果无影响;E项,未用盐酸溶液润洗量取用酸式滴定管,盐酸被稀释,所耗NaOH溶液体积偏小,测定结果偏低;使测定结果偏高的是AC,答案选AC。
分析。A项,滴定前,碱式滴定管尖有气泡,滴定后消失,所耗NaOH溶液体积偏大,测定结果偏高;B项,滴定前读数正确,达到滴定终点后,俯视读数,所耗NaOH溶液体积偏小,测定结果偏低;C项,滴定到终点读数时发现滴定管尖处悬挂一滴溶液,所耗NaOH溶液体积偏大,测定结果偏高;D项,盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗,对测定结果无影响;E项,未用盐酸溶液润洗量取用酸式滴定管,盐酸被稀释,所耗NaOH溶液体积偏小,测定结果偏低;使测定结果偏高的是AC,答案选AC。


科目:高中化学 来源: 题型:
【题目】在一次实验开放日活动中,某同学取出一无色溶液,向其中滴加酚酞试液后变成红色。该同学作出的下列结论中正确的是( )
A.该溶液能使石蕊试液变成蓝色B.该溶液的pH小于7
C.该溶液一定是碱溶液D.该溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题: 
(1)分类标准代号A表示(可多项)
a.两物质都是非电解质b.两物质都易溶于水
c.两物质都是含碳化合物d.两物质都是氧化物
(2)上述五种物质中的某一物质的饱和溶液中通入足量CO2 , 溶液中会有晶体析出.该反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
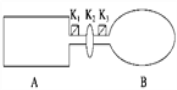
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000mol/L的氨水中逐滴加入0.100mol/L的盐酸,pH随盐酸体积的变化如图所示(不考虑NH3的逸出)。下列说法不正确的

A. 反应过程中: c(NH4+)+c(H+)=c(OH-)+c(Cl-)
B. V(HCl)=10.00mL时,c(NH3·H2O)>c(NH4+)>c(Cl-)
C. V(HCl)<20.00mL时,溶液不一定呈碱性
D. v(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 钠保存在煤油里的原因之一是它极易与氧气反应
B. 铝在空气中很容易燃烧
C. 镁表面的氧化膜疏松,不能保护内层金属
D. 铁锈的主要成分是Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示. 
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 .
②据报道高锰酸钾受热分解不产生MnO2 , 已知产气率= ![]() ×100%.若只发生KMnO4
×100%.若只发生KMnO4 ![]() KMnO2+O2↑,则产气率为 .
KMnO2+O2↑,则产气率为 .
③XRD谱显示还会分解产生K2MnO4和K2Mn4O8 , 写出分解产生这两种物质及氧气的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色.
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO; ③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O
(2)上述实验过程②与③中,I2起到了的作用.
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 碳酸钠比碳酸氢钠易溶于水
B. 碳酸钠比碳酸氢钠稳定
C. 碳酸钠和碳酸氢钠能跟石灰水反应得到白色沉淀
D. 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应,得到相同质量的二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com