
【题目】下列事实不能用化学平衡移动原理解释的是( )
A. 光照新制的氯水时,溶液的pH逐渐减小
B. 工业生产中,500℃左右比常温下更有利于合成氨
C. 可用浓氨水和氢氧化钠固体快速制取氨气
D. 增大压强,有利于SO2和O2反应生成SO3
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的叙述正确的是( )
A. 陶瓷、玻璃、水泥都是硅酸盐产品
B. 水晶、玛瑙、光纤、硅胶的主要成分都是SiO2
C. SiO2很稳定,与所有的酸都不反应
D. 单质硅是制作光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
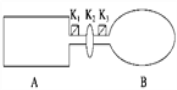
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 钠保存在煤油里的原因之一是它极易与氧气反应
B. 铝在空气中很容易燃烧
C. 镁表面的氧化膜疏松,不能保护内层金属
D. 铁锈的主要成分是Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示. 
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 .
②据报道高锰酸钾受热分解不产生MnO2 , 已知产气率= ![]() ×100%.若只发生KMnO4
×100%.若只发生KMnO4 ![]() KMnO2+O2↑,则产气率为 .
KMnO2+O2↑,则产气率为 .
③XRD谱显示还会分解产生K2MnO4和K2Mn4O8 , 写出分解产生这两种物质及氧气的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机物的分子式为C4H4 , 分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( ) 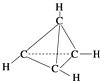
A.2 种
B.4种
C.5种
D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色.
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO; ③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O
(2)上述实验过程②与③中,I2起到了的作用.
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL 1mol / L NaOH溶液中,Na+的物质的量浓度为( )
A. 40g/mol B. 1.0mol/L C. 0.2mol D. 0.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华民族为人类文明进步做出巨大贡献。下列说法中不正确的是( )
A.商代后期铸造出工艺精湛的铜合金司母戊鼎,铜属于金属晶体
B.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
C.宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜
D.“文房四宝”中的砚台是用石材制作而成的,制作过程发生化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com