
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。许多科学家认为从空气中捕获二氧化碳不仅在理论上可行,很快还会成为一个对付全球变暖的实用武器;目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.HOCH2CH2NH2 C.CH3CH2OH D.NH4Cl
(2)工业上用NH3捕碳可合成CO (NH2)2:
已知:①标准状况下,11.2L NH3与足量CO2完全反应生成NH2CO2 NH4 (s)时放出39.8kJ的热量;②NH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) △H=+72.5 KJ·mol-1。
则2NH3(g)+CO2(g)=CO(NH2)2(s)+ H2O(g)的△H=_____________KJ·mol-1。
(3)用(NH4)2CO3捕碳的反应如下:
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:

①c点的逆反应速率和d点的正反应速率的大小关系为V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为 _____________。(填“>”、“=”或“<”)
③在T2~T4温度区间,容器内CO2气体浓度呈现先减小后增大的变化趋势,其原因是________。
(4)用碱性溶液也可捕碳:在常温下,将0.04mol CO2通入200mL 0.2mol/L的Na2S溶液中,已知: H2CO3的电离平衡常数:K1=4.3×10—7、K2=5.6×10—11;H2S的电离平衡常数:K1=5.0×10—8、K2=1.1×10—12。回答下列问题
①发生反应的离子方程式为_____________________________
②充分反应后下列关系式中正确的是_____________________
A.(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
B.c(CO32-)+ c(HCO3-)+ c(H2CO3)>c(H2S)+c(HS-)+c(S2-)
C.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
③计算反应后的溶液中c(H2S).c(OH-)/c(HS-)的值为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(gL-1)如图所示。已知盐酸浓度大于1molL-1时,发生反应:PbCl2(s)+2Cl-(aq)═PbCl42-(aq)。下列叙述正确的是
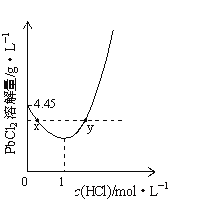
A. 盐酸浓度越小,Ksp(PbCl2)越小
B. x、y两点对应的溶液中c(Pb2+)相等
C. 当盐酸浓度为1molL-1时,溶液中c(Pb2+)一定最小
D. 当盐酸浓度小于1molL-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.5mol·L-1的盐酸与50mL 0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________________。由图可知该装置仍有不妥之处,如不改正,求得的中和热数值会____________(填“偏大”“偏小”“无影响”)。
(2)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_______________。
(3)取50 mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.1 | ________________ |
2 | 25.9 | 25.9 | 25.9 | 29 | |
3 | 27.0 | 27.4 | 27.2 | 31.7 | |
4 | 26.4 | 26.2 | 26.3 | 29.2 | |
②近似认为0.55 mol·L-1 NaOH溶液和0.50 mol·L-1盐酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=________(取小数点后一位)。
(4)下列情况会使测得中和热的数值偏小的是________(填字母)。
A.用浓硫酸代替盐酸进行上述实验
B. 用相同浓度和体积的氨水代替NaOH溶液进行上述实验
C. 用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应:2SO2(气)+ O2(气)![]() 2SO3(气)。已知反应过程中的某一时刻SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达平衡时,可能存在的数据是
2SO3(气)。已知反应过程中的某一时刻SO2、O2、SO3的浓度分别为:0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达平衡时,可能存在的数据是
A. SO2为0.25 mol·L-1
B. SO2、SO3均为0.15 mol·L-1
C. SO2为0.4 mol·L-1
D. SO2为0.4 mol·L-1,O2为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是
A. 称量时,将Na2CO3固体直接放在托盘天平的右盘上
B. 将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知下列热化学方程式:
①2C(s)+O2(g)=2CO(g) ΔH=-220.0 kJmol-1;
②C(s)+O2(g)=CO2(g) ΔH =-393.5 kJmol-1;
③2CO(g)+O2(g)=2CO2(g) ΔH =-566.0 kJmol-1;
④CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH =-890.0 kJmol-1。
请回答下列问题:
(1)CO的燃烧热为________________。
(2)炽热的木炭与二氧化碳反应生成一氧化碳的反应为___ (填“放热”或“吸热”)反应,理由是____________。
(3)写出甲烷与氧气反应生成CO的热化学方程式:_________________________。
Ⅱ.常温常压下,一定质量的无水乙醇(C2H5OH)完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,请写出乙醇燃烧的热化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,电离常数Ka(HF)=3.6×104 mol/L,溶度积常数Ksp(CaF2)=1.46×1010 mol3·L3。现向1 L0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液,则下列说法中,正确的是
A. 25℃时,0.1 mol/L HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中Ksp(CaF2)=![]()
D. 该体系中有CaF2沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是____________,X、Y、Z、W、M的原子半径由大到小的顺序为:__________________________(用元素符号表示)。
(2)写出Y2X6的电子式_____;Z2X4结构式______;X2W2所含化学键的类型______。
(3)用电子式描述M2N所形成化合物的形成过程_________________________。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为__________________。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com