
【题目】已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是____________,X、Y、Z、W、M的原子半径由大到小的顺序为:__________________________(用元素符号表示)。
(2)写出Y2X6的电子式_____;Z2X4结构式______;X2W2所含化学键的类型______。
(3)用电子式描述M2N所形成化合物的形成过程_________________________。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为__________________。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式__________________。
【答案】第二周期第ⅣA族 Na>C>N>O>H 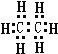
![]() 极性键和非极性键(或共价键)
极性键和非极性键(或共价键) ![]() H++HSO3﹣═H2O+SO2↑ N2H4+2H2O2═N2+4H2O
H++HSO3﹣═H2O+SO2↑ N2H4+2H2O2═N2+4H2O
【解析】
X、Y、Z、W、M、N为短周期元素且原子序数依次增大,由火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,分子内各原子最外层电子都满足稳定结构可知,X为H元素、Z为N元素、W为O元素;W与N同主族,则N为S元素;X与M同主族,且原子序数小于N,则M为Na元素;元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,则Y为C元素。
(1)Y是C元素,C元素位于周期表第二周期第ⅣA族;同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径依次增大,则X、Y、Z、W、M的原子半径由大到小的顺序是Na>C>N>O>H,故答案为:第二周期第ⅣA族;Na>C>N>O>H;
(2)X为H元素、Y为C元素、Z为N元素、W为O元素,Y2X6为C2H6,C2H6为共价化合物,电子式为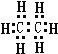 ;Z2X4为N2H4,结构式为
;Z2X4为N2H4,结构式为![]() ;X2W2为H2O2,H2O2含有的化学键为极性键和非极性键,故答案为:
;X2W2为H2O2,H2O2含有的化学键为极性键和非极性键,故答案为: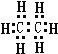 ;
;![]() ;极性键和非极性键;
;极性键和非极性键;
(3)M为Na元素、N为S元素,M2N为Na2S,Na2S为离子化合物,由钠离子和硫离子形成,用电子式表示Na2S的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
(4)X为H元素、W为O元素、M为Na元素、N为S元素,均含X、W、M、N四种元素的两种化合物分别为NaHSO4和NaHSO3,溶液中NaHSO4和NaHSO3反应生成硫酸钠、二氧化硫和水,反应的离子方程式为H++HSO3﹣═H2O+SO2↑,故答案为:H++HSO3﹣═H2O+SO2↑;
(4)X为H元素、Z为N元素、W为O元素,Z2X4为N2H4,X2W2为H2O2,N2H4与H2O2反应生成氮气和水,反应的化学方程式为N2H4+2H2O2═N2↑+4H2O,故答案为:N2H4+2H2O2═N2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为 CuFeS2。试回答下列问题:
(1)基态硫原子核外电子有_____种不同运动状态,能量最高的电子所占据的原子轨道形状为_________。
(2)基态Cu原子的价层电子排布式为_________;Cu、Zn的第二电离能大小I2(Cu) _________I2(Zn)(填“>”“<”或“=”)。
(3)SO2分子中S原子的轨道杂化类型为_________,分子空间构型为_________;与SO2互为等电子体的分子有_________(写一种)。
(4)请从结构角度解释H2SO3的酸性比H2SO4酸性弱的原因_________。
(5)Cu(CH3CN)4比四氨合铜离子稳定,其配离子中心原子配位数为_________,配位体中σ键与π键个数之比为_________。
(6)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间距离为anm。则该晶体的密度为_________g/cm3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,按要求填空:
(1)在25℃、101kPa下,1mol乙醇燃烧生成CO2和液态水时放热1269.6kJ.则表示乙醇燃烧热的热化学方程式为______.
(2)已知拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为______.
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=﹣196.6kJmol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJmol﹣1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=______kJmol﹣1.
(4)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是![]()
![]()
石油![]() 分馏产品
分馏产品![]() 乙烯
乙烯![]() .
.
A. 石油主要是由烃组成的混合物
B. ![]() 主要发生物理变化
主要发生物理变化
C. ![]() 包括裂化、裂解等过程
包括裂化、裂解等过程
D. ![]() 是加成反应,产物名称是二溴乙烷
是加成反应,产物名称是二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是
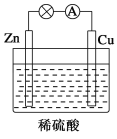

A. ①②③ B. ①②④ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:
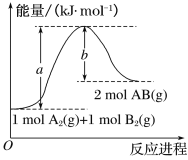
①该反应的ΔH_______0(填 “大于”“小于”或“等于”);
②反应物的总键能为______________;
③写出该反应的热化学方程式________________________________。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
写出联氨的结构式_______________,上述反应热效应之间的关系式为ΔH4=__________,联氨和N2O4可作为火箭推进剂的主要原因为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等,下列判断不正确的是
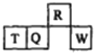
A. 最简单气态氢化物的热稳定性:R>Q B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R D. 含T的盐溶液一定能与碱反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com