
【题目】下列说法错误的是![]()
![]()
石油![]() 分馏产品
分馏产品![]() 乙烯
乙烯![]() .
.
A. 石油主要是由烃组成的混合物
B. ![]() 主要发生物理变化
主要发生物理变化
C. ![]() 包括裂化、裂解等过程
包括裂化、裂解等过程
D. ![]() 是加成反应,产物名称是二溴乙烷
是加成反应,产物名称是二溴乙烷
【答案】D
【解析】
![]() 石油主要成分是多种烷烃、环烷烃、芳香烃的混合物,因此石油主要是由烃组成的混合物,A正确;
石油主要成分是多种烷烃、环烷烃、芳香烃的混合物,因此石油主要是由烃组成的混合物,A正确;
B.分馏是利用沸点不同进行分离混合物,没有新物质产生,发生的是物理变化,B正确;
C.裂化目的的把长链烃断裂为短链烃,以获得更多的轻质液态燃料,裂解是以石油分馏得到的馏分为原料,采用比裂化更高的温度,把烃断裂为短链气态不饱和烃的过程,在这两个过程中都是把大分子的烃转化为小分子烃的过程,反应产物中既有饱和烃,也有不饱和烃,如乙烯的产生,②包括裂化、裂解等过程,C正确;
D.乙烯与溴加成生成CH2Br-CH2Br,所以③是加成反应,CH2Br-CH2Br的名称为1,![]() 二溴乙烷,D错误;
二溴乙烷,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是
A. 称量时,将Na2CO3固体直接放在托盘天平的右盘上
B. 将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol O3和3 mol O2的质量之比________,分子数之比________,同温同压的密度之比为________,含氧原子数之比为________,体积之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是____________,X、Y、Z、W、M的原子半径由大到小的顺序为:__________________________(用元素符号表示)。
(2)写出Y2X6的电子式_____;Z2X4结构式______;X2W2所含化学键的类型______。
(3)用电子式描述M2N所形成化合物的形成过程_________________________。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为__________________。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是
CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是
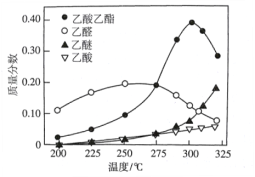
A. 反应温度不宜超过300℃
B. 该反应属于消去反应
C. 在催化剂作用下,乙醛是反应历程中的中间产物
D. 提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
(2)在海洋循环中,通过下图所示的途径固碳。

①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有浓度均为3mol·L-1的盐酸和硫酸各100mL,分别加入等质量的Fe粉,反应完毕后生成气体的质量之比为3:4,则加入盐酸中的铁粉的质量为
A. 5.6g B. 8.4g C. 11.2g D. 16.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s) + H2O(l)![]() 2 NH3(g)+CO2(g) △H=+133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
2 NH3(g)+CO2(g) △H=+133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
a. 从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b. 在平衡体系中增加水的用量可使该反应的平衡常数增大
c. 降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气。
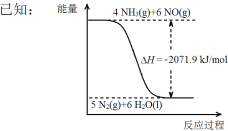
结合①中信息,尿素还原NO(g)的热化学方程式是 。
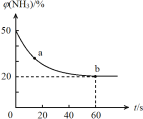
③密闭容器中以等物质的量的NH3和CO2为原料,在120 ℃、催化剂作用下反应生成尿素:CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率v正(CO2) b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率v正(CO2) b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是 ;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中存在的所有离子浓度大小关系是c(Na+)>________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com