
【题目】向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应,计算:
(1)Al的物质的量__________。
(2)参加反应的NaOH的物质的量__________和NaOH溶液的物质的量浓度___________。
(3)生成的H2在标准状况下的体积____________。
【答案】0.4mol 0.4mol 0.8mol/L 13.44L
【解析】
(1)依题意可知:铝的物质的量为n=![]() ;
;
(2)设参加反应的NaOH的物质的量为xmol,根据Al和NaOH的反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑及其对应关系求解;
(3) 根据Al和NaOH的反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑中反应物和生成物的对应关系解答。
(1)依题意可知:铝的物质的量为n=![]() =
=![]() mol=0.4mol;
mol=0.4mol;
(2)设参加反应的NaOH的物质的量为xmol,根据Al和NaOH的反应方程式可知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,参加反应的NaOH的物质的量和铝的物质的量相等,即0.4mol,NaOH溶液的物质的量浓度c=![]() =
=![]() =0.8mol/L;
=0.8mol/L;
(3) 根据Al和NaOH的反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知生成H2的物质的量n(H2)= ![]() n(Al)=
n(Al)= ![]() ×0.4mol=0.6mol,标准状况下的体积V=n×Vm=0.6mol×22.4L/mol=13.44L。
×0.4mol=0.6mol,标准状况下的体积V=n×Vm=0.6mol×22.4L/mol=13.44L。


科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
A.1 mol KClO3参加反应有2 mol电子转移
B.ClO2是氧化产物
C.H2C2O4在反应中被还原
D.KClO3在反应中得到电子,作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为___,有__个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是__。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因__。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是__。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__,微粒之间存在的作用力是__。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__。
,0)。则D原子的坐标参数为__。
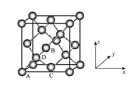
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为__g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法不正确的是

A.反应过程①的热化学方程式为A2(g)+B2(g)=C(g) ΔH1=-Q kJ/mol
B.反应过程②的热化学方程式为C(g)=A2(g)+B2(g) ΔH2=+Q1 kJ/mol
C.Q与Q1的关系:Q>Q1
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量的Cu(NO3)2溶液,下列说法中正确的是( )
A. 阳极发生的电极反应为Cu2++2e﹣═Cu
B. 阴极发生的电极反应为4OH﹣﹣4e﹣═2H2O+O2↑
C. 若有6.4g金属Cu析出,生成的O2一定为0.05mol
D. 电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法不正确的是( )

A.a电极上的电极反应式为N2H4+2O2--4e-=N2↑+2H2O
B.电子流动方向:电极a→电极b
C.b极附近的pH值变大
D.当电极a上消耗1molN2H4时,电极b上被还原的O2在标准状况下体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
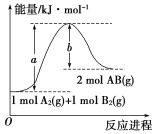
(1)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示请写出该反应的热化学方程式____。
(2)实验测得,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧的热化学方程式:_______。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为_________。
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是
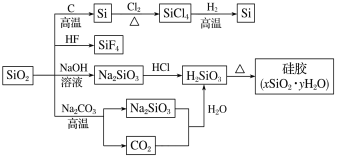
A.SiO2属于两性氧化物B.酸性:H2SiO3>H2CO3
C.硅胶吸水后可重复再生D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com