
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为___,有__个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是__。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因__。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是__。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__,微粒之间存在的作用力是__。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__。
,0)。则D原子的坐标参数为__。
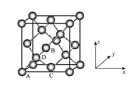
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为__g·cm-3(列出计算式即可)。
【答案】1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2 2 Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键 GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强 O>Ge>Zn sp3 共价键 (![]() ,
,![]() ,
,![]() )
) ![]() ×107
×107
【解析】
(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,根据其核外电子排布可知核外有2对未成对电子;
(2)Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键,所以Ge原子之间难以形成双键或叁键;
(3)根据表格GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是三者熔沸点均较低,为分子晶体,分子结构相似,分子量依次增大,分子间相互作用力逐渐增强,熔沸点逐渐升高;
(4)元素非金属性:Zn<Ge<O,元素的非金属性越强,吸引电子的能力越强,元素的电负性越大,故电负性:O>Ge>Zn;
(5)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,Ge原子形成4个σ键,采取sp3杂化;Ge单晶属于原子晶体,Ge原子靠共价键聚集;
(6)①D与周围4个原子形成正四面体结构,D与顶点A的连线处于晶胞体对角线上,根据正四面体的几何特性可知,D在xy平面上的投影应为AC的一半,在xz平面上的投影为AB的一半,A为坐标原点,B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0),则D为(
,0),则D为(![]() ,
,![]() ,
,![]() );
);
②根据均摊法,该晶胞中Ge原子的数目为![]() =8,则晶胞质量m=
=8,则晶胞质量m=![]() ,晶胞的体积V=a3pm3=565.763×10-30cm3,所以晶胞的密度为
,晶胞的体积V=a3pm3=565.763×10-30cm3,所以晶胞的密度为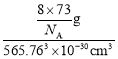 =
=![]() ×107 g·cm-3。
×107 g·cm-3。


科目:高中化学 来源: 题型:
【题目】用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如图:
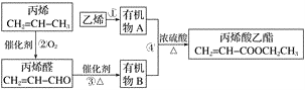
根据以上材料和你所学的化学知识,回答下列问题:
(1)乙烯的电子式是_____,官能团的名称是______。
(2)除去甲烷中的乙烯所用的试剂是____(填序号)。
A.稀硫酸
B.溴的四氯化碳溶液
C.水
D.酸性高锰酸钾溶液
(3)反应①的化学方程式是______,反应类型是_____。
(4)反应④的化学方程式是______,反应类型是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)==CO2(g)+2H2O(g)△H=-890.3kJ/mol
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ/mol
2NH3(g)△H=-38.6kJ/mol
C.NaOH(s)+1/2 H2SO4(浓)==1/2Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
D.2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)△H=-2589.6kJ/moL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
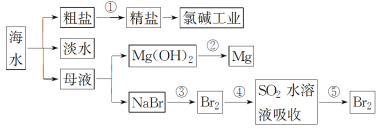
(1)过程①是为了除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,若要除去SO42-,则需要加入的试剂为_____________;若所加的该试剂过量,则可以被后加入的________________除去。
(2)过程②能否一步实现转化?______________(填“能”或“否”),Mg(OH)2与盐酸反应可以得到MgCl2溶液,则该反应的离子方程式为_____________________________________________。
(3)过程④反应的离子方程式为_____________________________________________________。
(4)若用CCl4萃取溴水中的Br2,分液时CCl4层应从分液漏斗的_____________放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.2.3g金属钠变为钠离子时失去的电子数目为0.1NA
B.标准状况下,18g水所占体积为22.4L
C.20℃ 1.01×105 Pa时,11.2L氢气所含的原子数目为NA
D.32g氧气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应,计算:
(1)Al的物质的量__________。
(2)参加反应的NaOH的物质的量__________和NaOH溶液的物质的量浓度___________。
(3)生成的H2在标准状况下的体积____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )

A. a管发生吸氧腐蚀,b管发生析氢腐蚀
B. 一段时间后,a管液面高于b管液面
C. a处溶液的pH增大,b处溶液的pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
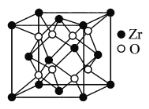
【题目】据世界权威刊物《自然》最近报道, 选择碲化锆 (ZrTe5)为材料验证了三维量子霍尔效应, 并发现了金属-绝缘体的转换。Te属于ⅥA元素。回答下列问题:
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是___,Zr2+的价电子排布图是___。
(2)O、Se、Te的第一电离能由大到小的顺序是___,H2O、H2Se、H2Te的沸点由高到低的顺序是___。
(3)H2Te和CO2 均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是___。
(4) [Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___(填符号), 1个[Zr(C2H5O)2]2+离子中含共价键的数目是___。
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是___。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为___ g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com