
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 明矾可用作净水剂 B. 单晶硅是光导纤维的主要成分
C. 1mol O3中含有的分子数为3NA D. 1mol·L-1BaCl2溶液中含有的氯离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 28g乙烯与环丁烷的混合气体中含有6NA个原子
B. 足量MnO2和含有2molHCl的浓盐酸共热,完全反应可生成0.5NA个Cl2分子
C. 标准状况下,22.4LNO2溶于水转移NA个电子
D. 6g金刚石中含有2NA个碳碳单健
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图。关于该有机物的叙述中正确的是

① 在Ni催化条件下1mol该有机物可与3mol H2发生加成;
② 该有机物不能发生银镜反应;
③ 该有机物分子式为C12H22O2;
④ 该有机物的同分异构体中不可能有酚类;
⑤ 1 mol该有机物水解时只能消耗1 mol NaOH
A. ②③④ B. ①④⑤ C. ②④⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组中:
①金刚石 ②12C ③液氯 ④ 14C ⑤CH3CH2CH2CH3 ⑥氯水
⑦ 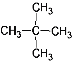 ⑧
⑧![]() ⑨C60。
⑨C60。
属于同素异形体的是__________(用序号回答,下同),属于同分异构体的是________,属于同位素的是______________。
(2)有a、MgBr2;b、金刚石;c、NaOH;d、干冰四种物质,按下列要求回答(用字母序号回答):
①熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是_________,熔点最高的是_____________。
②只有离子键的物质是___________,既有离子键又有共价键的物质是_________,晶体以分子间作用力结合的是______________。
(3)已知0.2mol烷烃在足量氧气中完全燃烧,测得生成CO2气体的体积为17.92L(标况下),则该烷烃的分子式为_________________,写出比该烃多1个碳的同系物,且其分子结构中含有3个甲基(-CH3)的结构简式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:镁电池的总反应为xMg+Mo3S4![]() MgxMo3S4,锂硫电池的总反应为2Li+S
MgxMo3S4,锂硫电池的总反应为2Li+S![]() Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是
Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是

A. 锂电池放电时,Mg2+向负极迁移
B. 镁电池放电时,正极发生的电极反应为Mo3S4+xMg2++2xe-==MgxMo3S4
C. 理论上两种电池的比能量相同
D. 图中Li作负极,Mo3S4作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每到冬季,雾霾天气肆虐京津冀等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
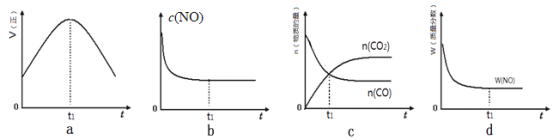
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)![]() N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式__________________。
(3)甲烷燃料电池可以提升能量利用率。
①碱性介质中甲烷燃料电池的负极反应式_________________________。
②如果电路上有0.1mol电子通过,理论上消耗标准状况下氧气的体积为_______。
(4)已知燃料电池的比能量与单位质量的燃料失去的电子数成正比。理论上,氢气、甲烷、甲醇燃料电池的比能量从大到小的顺序是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烃的说法中正确的是
A. 烷烃不能发生加成反应,烯烃不能发生取代反应
B. 烷烃中含饱和键,烯烃、炔烃中含不饱和键
C. 能发生加成反应的一定是烯烃
D. 符合通式CnHn+2的一定是烷烃,符合通式CnH2n的一定是烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要的化合物.
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法.实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH﹣的阴离子交换柱,使Cl﹣和OH﹣发生交换.交换完成后,流出溶液的OH﹣用0.40mol/L的盐酸滴定,滴至终点时消耗盐酸25.00mL.则样品中氯的物质的量为________,x=________;
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则样品中FeCl3的物质的量分数为________.实验中,FeCl2可用铁粉与_________反应制得,FeCl3可用铁粉与________反应制得;
(3)氧化铁与氢碘酸反应的离子方程式为________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性溶液中反应制取(K2FeO4),其反应的离子方程式为 ________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com