
����Ŀ��ÿ������������������Ű���ȵ��������У�ȼú������β������ɿ�����Ⱦ��ԭ��֮һ��
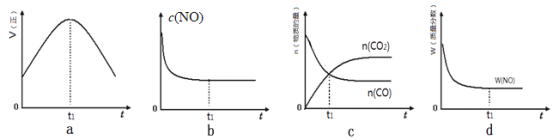
(l)����β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)��H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����________________������ţ���
2CO2(g)+N2(g)��H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����________________������ţ���
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⡣úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4(g)+2NO2(g)��N2(g)��CO2(g)+2H2O(g) ��H����867 kJ/mol ��
2NO2(g)![]() N2O4(g) ��H����56.9 kJ/mol ��
N2O4(g) ��H����56.9 kJ/mol ��
H2O(g)��H2O(l) ��H����44.0 kJ/mol ��
д��CH4����ԭN2O4(g)����N2��H2O��l�����Ȼ�ѧ����ʽ__________________��
��3������ȼ�ϵ�ؿ����������������ʡ�
�ټ��Խ����м���ȼ�ϵ�صĸ�����Ӧʽ_________________________��
�������·����0.1mol����ͨ�������������ı�״�������������Ϊ_______��
��4����֪ȼ�ϵ�صı������뵥λ������ȼ��ʧȥ�ĵ����������ȡ������ϣ����������顢�״�ȼ�ϵ�صı������Ӵ�С��˳����_________��
���𰸡� bd CH4(g)+ N2O4(g)��N2(g)��CO2(g)+2H2O(l)�ġ�H����898.1 kJ/mol CH4-8e��+10OH����CO32��+7H2O 0.56L ���������顢�״�
��������
��1����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬����
a������ƽ���������������ȣ����ٱ仯��t1ʱ��V�����֮���淴Ӧ�������ʷ����仯��δ����ƽ�⣬a����
b��NO��Ũ�����ŷ�Ӧ�Ľ�����С���ﵽ��ѧƽ���NO��Ũ�Ȳ��ٷ����仯��b��ȷ��
c��t1ʱ�̺�CO2��CO�����ʵ��������仯��t1ʱ��δ����ƽ��״̬��c����
d��t1ʱ��NO����������Ϊ��ֵ��˵��NO��Ũ�ȡ��ٷֺ������ٱ仯����t1ʱ���Ѿ��ﵽƽ��״̬��d��ȷ��
��ѡbd��
��2����֪��
CH4(g)+2NO2(g)��N2(g)��CO2(g)+2H2O(g) ��H����867 kJ/mol ��
2NO2(g)![]() N2O4(g) ��H����56.9 kJ/mol ��
N2O4(g) ��H����56.9 kJ/mol ��
H2O(g)��H2O(l) ��H����44.0 kJ/mol ��
���ݸ�˹���ɣ���-��+�ۡ�2�ɵ÷�ӦCH4(g)+N2O4(g)��N2(g)��CO2(g)+2H2O(l)�ġ�H����898.1 kJ/mol��
��3����ԭ����и�������������Ӧ�������ڸ���ͨ�룬���������£�����������Ӧ����̼�����ˮ�������缫��ӦʽΪCH4-8e��+10OH����CO32��+7H2O��
��1mol�����õ�4mol���ӣ������·����0.1mol����ͨ��������ݵ��ӵ�ʧ�غ��֪�������������ʵ�����0.1mol��4��0.025mol����״�������������Ϊ0.025mol��22.4L/mol��0.56L��
��4����֪ȼ�ϵ�صı������뵥λ������ȼ��ʧȥ�ĵ����������ȣ������������1g�������������顢�״�ʧȥ���ӵ����ʵ����ֱ���![]() ��
��![]() ��
��![]() ��������Ҫ�����ϣ����������顢�״�ȼ�ϵ�صı������Ӵ�С��˳�������������顢�״���
��������Ҫ�����ϣ����������顢�״�ȼ�ϵ�صı������Ӵ�С��˳�������������顢�״���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵ�ϡ��Һ�����������Լ�����һһ���������ǣ� �� ��Na2SO4��BaCl2��K2CO3��KNO3
��NaCl��AgNO3��Na2CO3��CaCl2
��CuSO4��BaCl2��NaOH��NaCl
��MgSO4��Na2CO3��Ba��NO3��2��H2SO4 ��
A.��
B.��
C.��
D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦCO32-+2H+=CO2��+H2O�е�H+���ܱ�ʾ
A.����B.��������C.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī�缫������е��ʵ��
ʵ��һ | ʵ��� | |
װ�� |
|
|
���� | a��d����ֽ����;b�����,�ֲ���ɫ;c�������Ա仯 | ����ʯī�缫���������ݲ���;n�������ݲ������� |
���ж�ʵ������Ľ��ͻ��Ʋⲻ�������ǣ� ��
A. a��d����2H2O+2e-=H2��+2OH- B. b����2Cl--2e-=Cl2��
C. c�������˷�Ӧ��Fe-2e-=Fe2+ D. ����ʵ��һ��ԭ��,ʵ�����m��������ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaCl��Һ����һ�����������������ϣ�һ��ʱ�����Һ�θ��ǵ�Բ��������(a)�ѱ���ʴ���䰵����Һ�������γ���ɫ���(b)����ͼ��ʾ�����¸��������Ҫԭ����Һ��֮�����������ȱ�Ե�١�����˵����ȷ������ ��

A. Һ���е�Cl�D��a����b��Ǩ��
B. Һ�α�Ե���������������ĵ缫��ӦΪ��O2��2H2O��4e��=4OH��
C. Һ���µ�Fe������ԭ��Ӧ������ʴ�����ɵ�Fe2����a����b��Ǩ�ƣ���b����OH�D�γ�Fe(OH)2����һ����������ˮ�γ�����
D. ������Ƕ��һͭ��˿�������壬��ͭ���Ӵ����μ�NaCl��Һ���������ĵ缫��ӦΪ��Cu��2e��=Cu2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ����
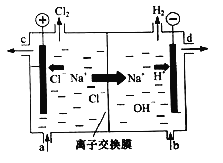
���������գ�
��1��д����ⱥ��ʳ��ˮ�����ӷ���ʽ_________��
��2�����ӽ���Ĥ������Ϊ��______��______��
��3�����Ʊ���ʳ��ˮ��ͼ��___________λ�ò��䣬����������Һ��ͼ��___________λ��������ѡ����a������b������c������d������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������ұ�(GB2760-2011)�涨���Ѿ���SO2���ʹ����Ϊ0.25 g��L-1��ij��ȤС����ͼ1װ��(�г�װ����)�ռ�ij���Ѿ���SO2�������京�����вⶨ��


��1������A��������_________��ˮͨ��A�Ľ���Ϊ_________��
��2��B�м���300.00 mL���Ѿƺ��������ᣬ����ʹSO2ȫ���ݳ�����C��H2O2��ȫ��Ӧ���仯ѧ����ʽΪ______________________________________________________��
��3����ȥC�й�����H2O2��Ȼ����0.090 0 mol��L-1NaOH����Һ���еζ����ζ�ǰ������ʱ��Ӧѡ��ͼ2�е�_________�����ζ��յ�ʱ��Һ��pH��8.8����ѡ���ָʾ��Ϊ_________������50 mL�ζ��ܽ���ʵ�飬���ζ����е�Һ���ڿ̶���10�����������Һ������(�����)_________(����10 mL������40 mL����<10 mL����>40 mL)��
��4���ζ����յ�ʱ������NaOH��Һ25.00 mL�������Ѿ���SO2����Ϊ_________g��L-1��
��5���òⶨ�����ʵ��ֵƫ�ߣ�����ԭ����������װ������Ľ���ʩ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����߽�������˻��ٿ��ڼ䣬�人�ȸ�����Ϊ��ʳ�Ĵ���֮һ�����ܴ��ں������ȸ��������������ѹ�����������������������������ӵ�ζ�����ĸ����ڡ�������������������С��������棬�ڷ�ˮ�����ؽ��̣����������Σ�ʹ֮�����ȣ�Ȼ��Ѹ��������ˮ��ʢ�����С��������⣬���������������������漰������ӽ�����( )
A.����B.����C.�ܽ�D.��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һƿA��B�Ļ�����֪���ҵ�ijЩ���������ʾ���� ��
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm-3 | ˮ�е��ܽ��� |
A | -75 | 66 | 0.93 | ���� |
B | -66 | 110 | 0.90 | ���� |
�ݴˣ������һ������ķ����ǣ� ��
A.����B.������C.��ȡ��D.���˷�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com