
【题目】现有一瓶A和B的混合物,已知甲和乙的某些性质如表所示:( )
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水中的溶解性 |
A | -75 | 66 | 0.93 | 可溶 |
B | -66 | 110 | 0.90 | 可溶 |
据此,将甲和乙互相分离的方法是( )
A.蒸馏法B.升华法C.萃取法D.过滤法
科目:高中化学 来源: 题型:
【题目】每到冬季,雾霾天气肆虐京津冀等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
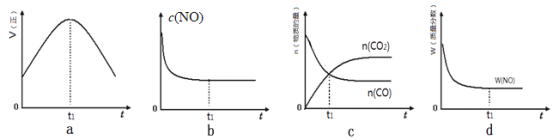
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)![]() N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式__________________。
(3)甲烷燃料电池可以提升能量利用率。
①碱性介质中甲烷燃料电池的负极反应式_________________________。
②如果电路上有0.1mol电子通过,理论上消耗标准状况下氧气的体积为_______。
(4)已知燃料电池的比能量与单位质量的燃料失去的电子数成正比。理论上,氢气、甲烷、甲醇燃料电池的比能量从大到小的顺序是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要的化合物.
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法.实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH﹣的阴离子交换柱,使Cl﹣和OH﹣发生交换.交换完成后,流出溶液的OH﹣用0.40mol/L的盐酸滴定,滴至终点时消耗盐酸25.00mL.则样品中氯的物质的量为________,x=________;
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则样品中FeCl3的物质的量分数为________.实验中,FeCl2可用铁粉与_________反应制得,FeCl3可用铁粉与________反应制得;
(3)氧化铁与氢碘酸反应的离子方程式为________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性溶液中反应制取(K2FeO4),其反应的离子方程式为 ________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下 列叙述不正确的是( )

A. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体0.1 mol,完全燃烧得0.16 mol CO2和3.6 g H2O,下列说法正确的是
A. 混合气体中一定有甲烷 B. 混合气体一定是甲烷和乙烯
C. 混合气体中可能有乙炔 D. 混合气体中一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( )
A.K+、HCO3﹣、CO32﹣、Br﹣
B.SO32﹣、HSO3﹣、OH﹣、K+
C.Fe3+、Cu2+、NO3﹣、SO32﹣
D.H+、Na+、NO3﹣、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则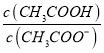 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com