
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则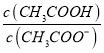 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
【答案】C
【解析】A.弱酸根离子水解是分步进行,向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+H2O![]() HCO3-+OH-,故A错误;B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,醋酸的电离平衡表示式为K=c(CH3COO-)c(H+)/c(CH3COOH),1.8×10-5/10-6= c(CH3COO-)/c(CH3COOH),
HCO3-+OH-,故A错误;B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,醋酸的电离平衡表示式为K=c(CH3COO-)c(H+)/c(CH3COOH),1.8×10-5/10-6= c(CH3COO-)/c(CH3COOH), 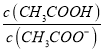 =1/18,B错误;C. NaHCO3溶液中的物料守恒为:c(Na+)= c(H2CO3)+c(HCO3-) +c(CO32-),电荷守恒为:c(H+)+c(Na+)=c(OH-)+c(HCO3-) +2c(CO32-),两式联列得:c(OH-) +c(CO32-)=c(H2CO3)+c(H+),故C正确;D.已知Ksp(CaCO3)=2.8×10-9= c(CO32-) c(Ca2+),2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合,c(CO32-)= 2×10-4 mol/L×/2V=1×10-4 mol/L,代入公式,得c(Ca2+)=2.8×10-5 mol/L,则原CaCl2溶液中c(Ca2+)≥2.8×10-5 mol/L×2==5.6×10-5 mol/L,故D错误。
=1/18,B错误;C. NaHCO3溶液中的物料守恒为:c(Na+)= c(H2CO3)+c(HCO3-) +c(CO32-),电荷守恒为:c(H+)+c(Na+)=c(OH-)+c(HCO3-) +2c(CO32-),两式联列得:c(OH-) +c(CO32-)=c(H2CO3)+c(H+),故C正确;D.已知Ksp(CaCO3)=2.8×10-9= c(CO32-) c(Ca2+),2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合,c(CO32-)= 2×10-4 mol/L×/2V=1×10-4 mol/L,代入公式,得c(Ca2+)=2.8×10-5 mol/L,则原CaCl2溶液中c(Ca2+)≥2.8×10-5 mol/L×2==5.6×10-5 mol/L,故D错误。


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】现有一瓶A和B的混合物,已知甲和乙的某些性质如表所示:( )
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水中的溶解性 |
A | -75 | 66 | 0.93 | 可溶 |
B | -66 | 110 | 0.90 | 可溶 |
据此,将甲和乙互相分离的方法是( )
A.蒸馏法B.升华法C.萃取法D.过滤法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离过程不涉及萃取的是( )
A.用四氯化碳分离碘水中的碘单质
B.屠呦呦团队科研人员从青蒿中提取青蒿素
C.用汽油除去衣服上的油污
D.粗盐的提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合液体:①乙酸乙酯和乙酸钠溶液,②乙醇和己醇,③碘化钠和单质碘的水溶液。分离以上混合液的正确方法依次是
A. 蒸馏、萃取、分液 B. 分液、萃取、蒸馏 C. 分液、蒸馏、萃取 D. 萃取、蒸馏、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在半透膜袋里盛有淀粉的氯化钠溶液,将半透膜袋悬挂在蒸馏水中,回答下列问题:(知识支持:淀粉遇碘单质变蓝)
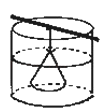
(1)取袋内液体,分为两份,一份中加入AgNO3溶液,则现象为________.另一份中加入碘水,现象为________
(2)一段时间后,做如下实验:取烧杯内液体,分为两份,一份中加入AgNO3溶液,则现象为________.另一份中加入碘水,现象为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 2 mol/L AlCl3溶液跟一定体积4 mol/L NaOH溶液混合后可得7.8 g沉淀,则NaOH溶液的体积可能是:①75 mL ②150 mL ③175 mL ④200 mL
A. ① B. ② C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯甲酸重结晶实验的说法错误的是
A. 溶解粗苯甲酸过程中,加热、玻璃棒搅拌均能提高苯甲酸的溶解度
B. 苯甲酸溶解时,若加水加热后仍有不溶物,说明该不溶物是不溶性杂质
C. 过滤时,趁热过滤可防止苯甲酸晶体提前析出
D. 冷却结晶时,温度过低杂质将析出,故此时温度不是越低越好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com