
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
【答案】 粉碎固体颗粒(其他合理答案也给分) 2MoS2+7O2![]() 2MoO3+4SO2 MoO3、SO2 MoO3+Na2CO3=Na2MoO4+CO2↑ PbS 当c(SO42-)=1.0×10-5mol/L,c(Ba2+)=Ksp(BaSO4)/c(SO42-)=1.1×10-10/1.0×10-5=1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以会析出BaMoO4沉淀 MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O
2MoO3+4SO2 MoO3、SO2 MoO3+Na2CO3=Na2MoO4+CO2↑ PbS 当c(SO42-)=1.0×10-5mol/L,c(Ba2+)=Ksp(BaSO4)/c(SO42-)=1.1×10-10/1.0×10-5=1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以会析出BaMoO4沉淀 MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O
【解析】(1)为了提高矿石的利用率,最常用的方法是将矿石粉碎,或者通入过量的空气;
(2)根据流程图和(2)中信息可写出反应的化学方程式为:2MoS2 +7O2![]() 2MoO3 +4SO2 由化合价变化情况分析可知,氧化产物为MoO3和 SO2;
2MoO3 +4SO2 由化合价变化情况分析可知,氧化产物为MoO3和 SO2;
(3)由流程图可知Na2CO3的加入与焙烧后的产物即MoO3作用生成CO2↑,而生产的最终产物是钼酸钠晶体,且在后面加入的沉淀剂是为了除去杂质铅的,也就是说钼酸钠在后续过程中没有发生变化,所以反应的化学方程式为 MoO3+Na2CO3=Na2MoO4 +CO2↑;
(4)当加入的沉淀剂为Na2S时,重金属离子即Pb2+则生成PbS废渣而除去;
(5)当SO42-完全沉淀,即c(SO42-)=1.0×10-5mol/L 时,由Ksp(BaSO4)= 1.1×10-10,求出c(Ba2+)=Ksp(BaSO4)/c(SO42-)=1.1×10-10/1.0×10-5=1.1×10-5mol/L,此时c(Ba2+)×c(MoO42-)=1.1
×10-5×0.40 =4.4×10-6 > Ksp(BaMoO4)=4.0×10-8,所以有BaMoO4沉淀析出;
(6)由题目叙述可知,反应物为钼精矿(MoS2)、碱和NaClO,生成物为钼酸钠和硫酸钠,结合化合价升降规律可知还有氯化钠生成,所以反应的离子方程式为MoS2+9ClO+6OH MoO42-+9Cl+2 SO42-+3H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:2CH3CH2OH ![]() CH3CH2OCHCH3+H2O
CH3CH2OCHCH3+H2O
实验步骤:
Ⅰ.乙醚的制备
在分液漏斗中加入2mL95%的乙醇,在一干燥的三颈烧瓶中放入12mL95%的乙醇,在冷水浴中的冷却下边摇动边缓慢加入12mL 浓硫酸,使混合均匀,并加入2 粒沸石.
实验装置如图: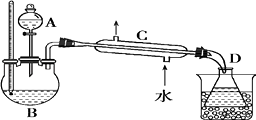
将反应瓶放在电热套上加热,使温度迅速地上升到140℃,开始由分液漏斗慢慢滴加乙醇,控制流速并保持温度在135~140℃之间.待乙醇加完后,继续反应10min,直到温度上升到
160℃止.关闭热源,停止反应.
Ⅱ.乙醚的精制
将馏出物倒入分液漏斗中,依次用8mL15%NaOH 溶液、8mL 饱和食盐水洗涤,最后再用8mL 饱和氯化钙溶液洗涤2 次,充分静置后分液.将乙醚倒入干燥的锥形瓶中,用块状无水氯化钙干燥.待乙醚干燥后,加入到蒸馏装置中用热水浴蒸馏,收集33~38℃的馏分.
请根据上述信息,完成下列问题:
(1)乙醚的制备和精制过程中都需要使用沸石,其作用是;如果实验中忘记加沸石,需要怎么处理;
(2)乙醚的制备和精制过程中都需要使用温度计,其水银球位置是否相同(填“是”或“否”),原因是;
(3)仪器C 的名称为;
(4)如果温度太高,将会发生副反应,产物是
(5)精制乙醚中,加入15%NaOH溶液的作用是 , 加入饱和氯化钙溶液的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 22.4 L O2中含有氧分子的个数为NA
B. 24 g Mg与足量氧气反应失去的电子数为2NA
C. 28 g N2中含有氮原子的个数为NA
D. 1 mol·L-1 MgCl2溶液中含有氯离子个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)漂白粉或漂粉精的有效成分是______(填化学式);
写出将氯气通入冷的消石灰中制取漂白粉的方程式____。
(2)![]() 的水溶液俗称_____,是制备硅胶和木材防火剂的原料。
的水溶液俗称_____,是制备硅胶和木材防火剂的原料。
(3)________是制造光导纤维的重要原料,生产普通玻璃和水泥都用到的原料是__。
(4)NO2是______色有毒气体,NO2与水反应的方程式为___________,标准状况下67.2L NO2与水反应转移电子______mol。
(5)中国的瓷器驰名世界,制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)H2S在水溶液中的电离方程式为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为___________。
②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为______________。
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=_________kJ/mol。
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g) ![]() CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
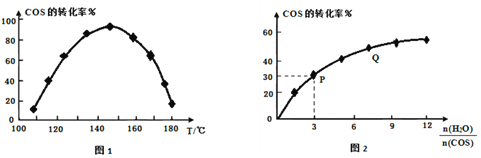
由图1可知,催化剂活性最大时对应的温度约为______,COS的转化率在后期下降的原因是_______________________________________。由图2可知,P点时平衡常数K=______(保留2位有效数字)。Q点转化率高于P点的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】少量杂质(括号内为杂质),选用试剂和分离方法能达到实验目的的是
混合物 | 试剂 | 分离方法 | |
A | 乙烷(乙烯) | (H+)KMnO4 | 洗气 |
B | 乙醇(H2O) | 新制CaO | 蒸馏 |
C | 苯(苯酚) | 溴水 | 过滤 |
D | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水开发利用的部分过程如图所示。

(1)操作1的名称是____,进行该操作时所需的玻璃仪器为烧杯、____;
(2)上述流程所得粗盐中含有的少量Ca2+、Mg2+、SO42-等杂质离子常用①Na2CO3溶液②BaCl2溶液③NaOH溶液④稀盐酸来进行除去,试剂的加入顺序为③____(填试剂序号);
(3)上述流程所得苦卤中通入Cl2后的溶液中溴的浓度极低,所以工业上一般要向该溶液中通入热空气,吹出的溴蒸气用二氧化硫水溶液吸收,再向吸收液中通入氯气得到较高浓度的溴水,写出溴与二氧化硫水溶液反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线正确的是( )

A. A曲线表示向AlCl3溶液中滴入NaOH溶液至过量
B. B曲线表示向NaAlO2溶液中通入CO2至过量
C. C曲线表示向n(HCl):n(AlC13)=1:1的混合溶液中滴入NaOH溶液至过量
D. D曲线表示向n[Ca(OH)2]:n(KOH)=1:2的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com