
【题目】(1)漂白粉或漂粉精的有效成分是______(填化学式);
写出将氯气通入冷的消石灰中制取漂白粉的方程式____。
(2)![]() 的水溶液俗称_____,是制备硅胶和木材防火剂的原料。
的水溶液俗称_____,是制备硅胶和木材防火剂的原料。
(3)________是制造光导纤维的重要原料,生产普通玻璃和水泥都用到的原料是__。
(4)NO2是______色有毒气体,NO2与水反应的方程式为___________,标准状况下67.2L NO2与水反应转移电子______mol。
(5)中国的瓷器驰名世界,制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为:________________。
【答案】 Ca(ClO)2 2Ca(OH)2+2Cl2====CaCl2+Ca(ClO)2+2H2O 水玻璃 SiO2(或二氧化硅) 石灰石(或CaCO3) 红棕 3NO2+H2O=2HNO3+NO 2 Al2O3·2SiO2·2H2O
【解析】(1)漂白粉或漂粉精的有效成分是Ca(ClO)2;将氯气通入冷的消石灰中制取漂白粉的方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O。(2)硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料。(3)SiO2是制造光导纤维的重要原料,生产普通玻璃和水泥都用到的原料是石灰石。(4)NO2是红棕色有毒气体,NO2与水反应的方程式为3NO2+H2O=2HNO3+NO,标准状况下67.2LNO2的物质的量是3mol,根据方程式可知氮元素从+4价降低到+2价,因此与水反应转移电子2mol。(5)根据化学式Al2Si2O5(OH)4可知若以氧化物形式表示黏土的组成,应写为Al2O3·2SiO2·2H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO![]() 、NO
、NO![]()
B. 将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O===HSO![]() +NH
+NH![]()
C. 用酒精萃取碘水中的碘,水从分液漏斗下口放出,碘的酒精溶液从分液漏斗上口倒出
D. 高炉炼铁原理是用一氧化碳还原四氧化三铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备Fe3O4纳米材料的流程示意图如下:


已知:步骤⑤中,相同条件下测得Fe3O4的产率与R( )的关系如图所示。
)的关系如图所示。
(1)为提高步骤①的反应速率,可采取的措施是_______________(任写一点) 。
(2)步骤②中,主要反应的离子方程式是________________________。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是___________________;步骤④中,反应完成后需再加热一段时间除去剩余H2O2目的是____________________________
(4)⑤反应的离子方程式为_________________ ;步骤⑤中的“分离”包含的步骤有______________________。
(5)设浊液D中FeOOH的物质的量为amol,滤液B中的铁元素的物质的量为bmol。为使Fe3O4的产率最高,则![]() =_________。(填数值,小数点后保留3位)
=_________。(填数值,小数点后保留3位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可用于制备常见的解热镇痛药阿司匹林.纯净的A为白色结晶性粉末,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 6.9g,升温使其汽化,测其密度是相同条件下CH4的8.625倍. | (1)A的相对分子质量为: . |
(2)将此6.9g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和15.4g | (2)A的分子式为: . |
(3)另取A 6.9g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况). | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱显示A有6种氢 | A的结构简式 |
(5)写出A与浓溴水反应的方程式: | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为18。下列叙述正确的是
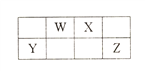
A. 氢化物的沸点:X<Z
B. 简单离子的半径:Y<X
C. 最高价氧化物对应水化物的酸性:Y>W
D. W与氢形成的所有化合物中的化学键均为极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.铁的摩尔质量就是铁的相对原子质量
B.SO42-的摩尔质量是96g/mol
C.1molO2的质量是32g/mol
D.CO2的摩尔质量是44g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B. 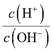 =1×10 12的溶液中:K+、Na +、CO32-、NO3-
=1×10 12的溶液中:K+、Na +、CO32-、NO3-
C. 浓度为3%的H2O2溶液:H+、Na+、C1-、SO32-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com