
����Ŀ���Ҵ��ķе���78�棬����ˮ������Ȼ��ܣ������Ȼ��ƽ�������������ѵķе�Ϊ34.6�棬������ˮ�����Ѽ���ȼ�գ�ʵ���������ѵķ�Ӧԭ���ǣ�2CH3CH2OH ![]() CH3CH2OCHCH3+H2O
CH3CH2OCHCH3+H2O
ʵ�鲽�裺
�����ѵ��Ʊ�
�ڷ�Һ©���м���2mL95%���Ҵ�����һ�����������ƿ�з���12mL95%���Ҵ�������ˮԡ�е���ȴ�±�ҡ����������12mL Ũ���ᣬʹ��Ͼ��ȣ�������2 ����ʯ��
ʵ��װ����ͼ��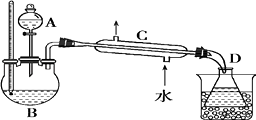
����Ӧƿ���ڵ������ϼ��ȣ�ʹ�¶�Ѹ�ٵ�������140�棬��ʼ�ɷ�Һ©�������μ��Ҵ����������ٲ������¶���135��140��֮�䣮���Ҵ����������Ӧ10min��ֱ���¶�������
160��ֹ���ر���Դ��ֹͣ��Ӧ��
�����ѵľ���
������ﵹ���Һ©���У�������8mL15%NaOH ��Һ��8mL ����ʳ��ˮϴ�ӣ��������8mL �����Ȼ�����Һϴ��2 �Σ���־��ú��Һ�������ѵ���������ƿ�У��ÿ�״��ˮ�Ȼ��Ƹ�������Ѹ�����뵽����װ��������ˮԡ�����ռ�33��38�����֣�
�����������Ϣ������������⣺
��1�����ѵ��Ʊ��;��ƹ����ж���Ҫʹ�÷�ʯ���������������ʵ�������Ǽӷ�ʯ����Ҫ��ô������
��2�����ѵ��Ʊ��;��ƹ����ж���Ҫʹ���¶ȼƣ���ˮ����λ���Ƿ���ͬ����ǡ�����ԭ������
��3������C ��������
��4������¶�̫�ߣ����ᷢ������Ӧ��������
��5�����������У�����15%NaOH��Һ�������� �� ���뱥���Ȼ�����Һ�������� ��
���𰸡�
��1����ֹ���У����ʵ�������Ǽӷ�ʯ��ֹͣ���ȣ���ȴ��
��2�����Ʊ�����Ҫ���Ʒ�ӦҺ���¶ȣ�ˮ����Ҫ���ڷ�ӦҺ�����Ҫ����ݵ��¶ȣ�Ҫ����֧�ܿڴ�
��3��������
��4����ϩ
��5����ȥ�������ʣ����Ҵ�
���������⣺��1��Һ����ȼӷ�ʯ���Ƿ�ֹҺ���ٷУ����ʵ�������Ǽӷ�ʯ��ֹͣ���ȣ���ȴ�ӣ�����Ҳ�������ٷУ��������ѵ��Ʊ��;��ƹ����ж���Ҫʹ�÷�ʯ���������Ƿ�ֹ���У����ʵ�������Ǽӷ�ʯ��ֹͣ���ȣ���ȴ�ӣ����Դ��ǣ���ֹ���У����ʵ�������Ǽӷ�ʯ��ֹͣ���ȣ���ȴ�ӣ���2�����ѵ��Ʊ�������Ҫ������Ӧ��Һ���¶ȣ�����ˮ����λ������Һ�м䣬�����ƹ�������Ҫ����������ķе㣬ˮ����λ����������ƿ��֧�ܴ����������ǵ�λ�ò�ͬ�����Դ��ǣ����Ʊ�����Ҫ���Ʒ�ӦҺ���¶ȣ�ˮ����Ҫ���ڷ�ӦҺ�����Ҫ����ݵ��¶ȣ�Ҫ����֧�ܿڴ�����3������װ��ͼ��֪����C������Ϊ�����ܣ����Դ��ǣ������ܣ���4���Ҵ���Ũ���������¼��ȵ�170��Ϳ���������ϩ������¶�̫�ߣ����ᷢ������Ӧ����������ϩ�����Դ��ǣ���ϩ����5�����������У�������п������������ʣ���������Ҵ��������ñ����Ȼ�����Һ��ȥ�����������У�����15% NaOH��Һ�������� ��ȥ�������ʣ����뱥���Ȼ�����Һ�������dz��Ҵ������Դ��ǣ���ȥ�������ʣ����Ҵ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ļ������й㷺��Ӧ�á�
��1�����������(NH4)2S2O8���Կ���˫��ˮ�������H2O2�����е�����Hԭ�ӱ���SO3H��ȡ����Ϊ�������ᡣ
��(NH4)2S2O8����Ԫ�صĻ��ϼ�Ϊ_________��
���ù����������Һ����ˮ�е�Mn2+����ƽ��������ӷ�Ӧ��_____S2O82��+____Mn2++_____=____MnO4��+____SO42��+____��
��2�����մ�ijɷ���Na2S2O3��5H2O�������ڷ��������������������1 mol Na2S2O3��ȫ��Ӧ��ʧȥ8mol���ӡ�д����ˮ��Һ�������������ӷ���ʽ______________��
��3�����Բ���A��������Ԫ����ɵĻ����ij�о�С�鰴��ͼ��ʾ����̽������ɣ�
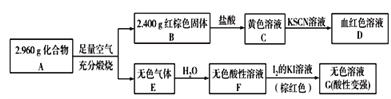
����֪������A�������ᷴӦ������һ�ֵ���ɫ�������һ������(��״�����ܶ�Ϊ1.518g/L)��д���÷�Ӧ�Ļ�ѧ����ʽ��_______________________��
����֪25 ��ʱ��Ksp[Fe(OH)3]��8��10��39�����¶��·�ӦFe(OH)3��3H��![]() Fe3����3H2O��ƽ�ⳣ��Ϊ_________(��ʽ������)����0.001 mol/L FeCl3��Һ��ͨ�백��(����仯���Բ���)����ʼ����ʱ��Һ��pHΪ________��(lg 5��0.7)
Fe3����3H2O��ƽ�ⳣ��Ϊ_________(��ʽ������)����0.001 mol/L FeCl3��Һ��ͨ�백��(����仯���Բ���)����ʼ����ʱ��Һ��pHΪ________��(lg 5��0.7)
��4����FeSO4��һ�������¿��Ƶ�FeS2(��������)���ײ���,�ò��Ͽ��������������﮵��,��طŵ�ʱ���ܷ�ӦΪ4Li+FeS2![]() Fe+2Li2S,������Ӧʽ��____��
Fe+2Li2S,������Ӧʽ��____��
��FeSO4��ת��ΪFeCO3,FeCO3�ڿ����м��Ȼᷢ����Ӧ,���Ƶ���ϵ��������ϡ���֪25 ����101 kPaʱ:4Fe(s)+3O2(g)![]() 2Fe2O3(s) ��H=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)��H=-392 kJ��mol-1;2Fe(s)+2C(s)+3O2(g)
2Fe2O3(s) ��H=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)��H=-392 kJ��mol-1;2Fe(s)+2C(s)+3O2(g)![]() 2FeCO3(s)��H=-1480 kJ��mol-1��FeCO3�ڿ����м��ȷ�Ӧ����Fe2O3���Ȼ�ѧ����ʽ��_______��
2FeCO3(s)��H=-1480 kJ��mol-1��FeCO3�ڿ����м��ȷ�Ӧ����Fe2O3���Ȼ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʰ��ռ�ᡢ��˳����ȷ��ϵ��ǣ���
A.Na2CO3 H2SO4 NaHCO3B.NaOH HCl NaCl
C.CH3COOH NaOH CaCl2D.KOH CaCO3 HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������Ա���������������ɶ����������1.5������������ 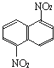 ����1.8������������
����1.8������������ 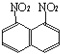 ���Ļ������߿�����������������98%�����ᣬ��ǰ�߲��ܣ�����������ʿ��Խ��������칹����룮�����������������������98%���ᣬ��ֽ��裬������©�����ˣ�������Һ�еõ�����1.8������������Ӧ�ʵķ����ǣ� ��
���Ļ������߿�����������������98%�����ᣬ��ǰ�߲��ܣ�����������ʿ��Խ��������칹����룮�����������������������98%���ᣬ��ֽ��裬������©�����ˣ�������Һ�еõ�����1.8������������Ӧ�ʵķ����ǣ� ��
A.����Ũ���ᾧ
B.����Һ�м���ˮ�����
C.��Na2CO3��Һ������Һ
D.����Һ��������ˮ�й���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. Ͷ����Ƭ����H2����Һ�пɴ�������H����Mg2����SO![]() ��NO
��NO![]()
B. ���������������������䰱ˮ�У�SO2��NH3��H2O===HSO![]() ��NH
��NH![]()
C. �þƾ���ȡ��ˮ�еĵ⣬ˮ�ӷ�Һ©���¿ڷų�����ľƾ���Һ�ӷ�Һ©���Ͽڵ���
D. ��¯����ԭ������һ����̼��ԭ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CCl4��ȡ��ˮ�� ˵���в���ȷ����
A. ����CCl4�е��ܽ�ȴ�����ˮ�е��ܽ��
B. ��ȡ��ˮ����ɫ��dz
C. ��ȡ��CCl4��Һ��Ϊ��ɫ
D. ��ȡ��ˮ����ɫ��������²�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�������ˮ�������ˮ���ʵ�������ȷ����(����)
A. ��Ϊ����ɫ B. ������Ư����
C. ��������������Һ������ɫ���� D. ����ʹ��ɫʯ����Һ�ʺ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. Ͷ����Ƭ����H2����Һ�пɴ�������H����Mg2����SO![]() ��NO
��NO![]()
B. ���������������������䰱ˮ�У�SO2��NH3��H2O===HSO![]() ��NH
��NH![]()
C. �þƾ���ȡ��ˮ�еĵ⣬ˮ�ӷ�Һ©���¿ڷų�����ľƾ���Һ�ӷ�Һ©���Ͽڵ���
D. ��¯����ԭ������һ����̼��ԭ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƾ��壨Na2MoO4��2H2O��������������ȼ������������ˮϵͳ�Ľ������Ƽ�����ͼ�������⾫����Ҫ�ɷ���MoS2��������PbS�ȣ�Ϊԭ�����������ƾ���Ĺ�������ͼ��

�ش��������⣺
��1����߱���Ч�ʵķ�����____________����дһ�֣�
��2�������ա�ʱMoS2ת��ΪMoO3���÷�Ӧ���̵Ļ�ѧ����ʽΪ________________________������������________��д��ѧʽ����
��3���������ʱ���⻯���������Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________________________��
��4���������ؽ������ӡ�ʱ����ij�����ΪNa2S��������ɷֵĻ�ѧʽΪ________��
��5����á����ؽ������ӡ��в������ӵ�Ũ�ȣ�c(MoO42-)=0.40mol/L��c(SO42-)=0.04mol/L�����ᾧ��ǰ���ȳ�ȥSO42-�������Ǽ���Ba(OH)2���塣�������Ba(OH)2�������Һ������䣬��SO42-��ȫ������c(SO42-)��1.0��10-5mol/L��ʱ��BaMoO4�Ƿ��������____________________________________���������˵����[��֪��Ksp(BaSO4)=1.1��10-10��Ksp(BaMoO4)=4.0��10-8]
��6���⾫���ڼ��������£�����NaClO��Һ��Ҳ�����Ʊ������ƣ�ͬʱ��SO42-���ɣ��÷�Ӧ�����ӷ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com