
【题目】在一定条件下,萘可以被硝硫混酸硝化生成二硝基物,它是1.5﹣二硝基萘( 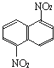 )和1.8﹣二硝基萘(
)和1.8﹣二硝基萘( 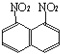 )的混合物.后者可溶于质量分数大于98%的硫酸,而前者不能.利用这个性质可以将这两种异构体分离.将上述硝化产物放入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1.8﹣二硝基萘,应彩的方法是( )
)的混合物.后者可溶于质量分数大于98%的硫酸,而前者不能.利用这个性质可以将这两种异构体分离.将上述硝化产物放入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1.8﹣二硝基萘,应彩的方法是( )
A.蒸发浓缩结晶
B.向滤液中加入水后过滤
C.用Na2CO3溶液处理滤液
D.将滤液缓缓加入水中过滤
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 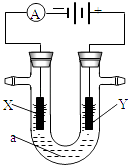
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为;在X极附近观察到的现象是 .
②Y电极上的电极反应式为;检验该电极反应产物的方法是 .
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 , 电极反应式为 .
②Y电极的材料是 , 电极反应式为 . (说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.强酸性溶液:K+、HCO3、Br、Ba2+
B.滴加酚酞溶液显红色的溶液:Fe3+、NH4+、Cl、NO3
C.强酸性溶液:Cu2+、Na+、Mg2+、SO42
D.含有大量HCO3的溶液:Na+、NO3、Cl、OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下均能通过一步反应实现的是( )
A. NaAlO2(aq)![]() AlCl3
AlCl3![]() Al2O3 B. N2
Al2O3 B. N2![]() NO2
NO2![]() HNO3
HNO3
C. NaCl(饱和)![]() NaHCO3
NaHCO3![]() Na2CO3 D. FeS2
Na2CO3 D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读相关信息,结合所学知识,回答下列问题:
(1)铝和锌都是两性金属元素。其氢氧化物都是白色沉淀,既能溶于强酸,又能溶于强碱(生成AlO2-或ZnO22-)。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
①写出锌和氢氧化钠溶液反应的化学方程式_________________________________。
②用氨水除去Al(OH)3中的Zn(OH)2的离子方程式为__________________________。
③写出向AlCl3溶液中滴入过量氨水的离子方程式___________________________;
向ZnCl2溶液中逐滴滴入氨水直至过量的现象是___________________________。
④下列各组中的两种溶液,只用胶头滴管和试管即可鉴别的是________________。
A.硫酸铝和氢氧化钠 B.硫酸铝和氨水
C.硫酸锌和氢氧化钠 D.硫酸锌和氨水
(2)Cu2O是一种红色难溶于水的固体,在空气中灼烧Cu2O会生成CuO;Cu2O溶于稀硫酸可生成Cu和Cu2+;Cu2O和Cu都能溶于稀硝酸。
研究性学习小组为检测Cu样品中是否含有Cu2O设计以下实验方案:
方案Ⅰ:取该红色样品溶于足量的稀硝酸中,观察是否有残渣剩余
方案Ⅱ:取该红色样品溶于足量的稀硫酸中,观察溶液颜色变化
方案Ⅲ:称量a g红色样品,在空气中充分灼烧至恒重,得到bg黑色固体。
①比较方案Ⅰ和方案Ⅱ,你认为合理的是方案_________(填“Ⅰ”或“Ⅱ”),合理方案的反应原理为________________________________________(用离子方程式表示)。
②方案Ⅲ中,如果 < b < (用含a的代数式表示)____________,可确认红色粉末含有Cu2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:2CH3CH2OH ![]() CH3CH2OCHCH3+H2O
CH3CH2OCHCH3+H2O
实验步骤:
Ⅰ.乙醚的制备
在分液漏斗中加入2mL95%的乙醇,在一干燥的三颈烧瓶中放入12mL95%的乙醇,在冷水浴中的冷却下边摇动边缓慢加入12mL 浓硫酸,使混合均匀,并加入2 粒沸石.
实验装置如图: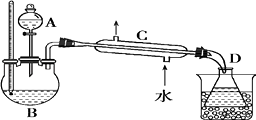
将反应瓶放在电热套上加热,使温度迅速地上升到140℃,开始由分液漏斗慢慢滴加乙醇,控制流速并保持温度在135~140℃之间.待乙醇加完后,继续反应10min,直到温度上升到
160℃止.关闭热源,停止反应.
Ⅱ.乙醚的精制
将馏出物倒入分液漏斗中,依次用8mL15%NaOH 溶液、8mL 饱和食盐水洗涤,最后再用8mL 饱和氯化钙溶液洗涤2 次,充分静置后分液.将乙醚倒入干燥的锥形瓶中,用块状无水氯化钙干燥.待乙醚干燥后,加入到蒸馏装置中用热水浴蒸馏,收集33~38℃的馏分.
请根据上述信息,完成下列问题:
(1)乙醚的制备和精制过程中都需要使用沸石,其作用是;如果实验中忘记加沸石,需要怎么处理;
(2)乙醚的制备和精制过程中都需要使用温度计,其水银球位置是否相同(填“是”或“否”),原因是;
(3)仪器C 的名称为;
(4)如果温度太高,将会发生副反应,产物是
(5)精制乙醚中,加入15%NaOH溶液的作用是 , 加入饱和氯化钙溶液的作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com