
【题目】下列说法正确的是( )
A. 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO![]() 、NO
、NO![]()
B. 将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O===HSO![]() +NH
+NH![]()
C. 用酒精萃取碘水中的碘,水从分液漏斗下口放出,碘的酒精溶液从分液漏斗上口倒出
D. 高炉炼铁原理是用一氧化碳还原四氧化三铁
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.强酸性溶液:K+、HCO3、Br、Ba2+
B.滴加酚酞溶液显红色的溶液:Fe3+、NH4+、Cl、NO3
C.强酸性溶液:Cu2+、Na+、Mg2+、SO42
D.含有大量HCO3的溶液:Na+、NO3、Cl、OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:2CH3CH2OH ![]() CH3CH2OCHCH3+H2O
CH3CH2OCHCH3+H2O
实验步骤:
Ⅰ.乙醚的制备
在分液漏斗中加入2mL95%的乙醇,在一干燥的三颈烧瓶中放入12mL95%的乙醇,在冷水浴中的冷却下边摇动边缓慢加入12mL 浓硫酸,使混合均匀,并加入2 粒沸石.
实验装置如图: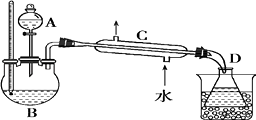
将反应瓶放在电热套上加热,使温度迅速地上升到140℃,开始由分液漏斗慢慢滴加乙醇,控制流速并保持温度在135~140℃之间.待乙醇加完后,继续反应10min,直到温度上升到
160℃止.关闭热源,停止反应.
Ⅱ.乙醚的精制
将馏出物倒入分液漏斗中,依次用8mL15%NaOH 溶液、8mL 饱和食盐水洗涤,最后再用8mL 饱和氯化钙溶液洗涤2 次,充分静置后分液.将乙醚倒入干燥的锥形瓶中,用块状无水氯化钙干燥.待乙醚干燥后,加入到蒸馏装置中用热水浴蒸馏,收集33~38℃的馏分.
请根据上述信息,完成下列问题:
(1)乙醚的制备和精制过程中都需要使用沸石,其作用是;如果实验中忘记加沸石,需要怎么处理;
(2)乙醚的制备和精制过程中都需要使用温度计,其水银球位置是否相同(填“是”或“否”),原因是;
(3)仪器C 的名称为;
(4)如果温度太高,将会发生副反应,产物是
(5)精制乙醚中,加入15%NaOH溶液的作用是 , 加入饱和氯化钙溶液的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可再生的物质制备乙酸乙酯的绿色合成路线之一如图所示: 
下列说法正确的是( )
A.常温下,M能与银氨溶液发生反应
B.④的反应类型属于酯化反应,不属于取代反应
C.用饱和碳酸钾溶液能鉴别乙醇、乙酸和乙酸乙酯
D.淀粉和纤维素的化学式均为(C6H10O5)n , 二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯化镁和氯化铝的200 mL 混合溶液中,c(Mg2+)为 0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为( )
A. 40 mL B. 72 mL C. 80 mL D. 128 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 22.4 L O2中含有氧分子的个数为NA
B. 24 g Mg与足量氧气反应失去的电子数为2NA
C. 28 g N2中含有氮原子的个数为NA
D. 1 mol·L-1 MgCl2溶液中含有氯离子个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水开发利用的部分过程如图所示。

(1)操作1的名称是____,进行该操作时所需的玻璃仪器为烧杯、____;
(2)上述流程所得粗盐中含有的少量Ca2+、Mg2+、SO42-等杂质离子常用①Na2CO3溶液②BaCl2溶液③NaOH溶液④稀盐酸来进行除去,试剂的加入顺序为③____(填试剂序号);
(3)上述流程所得苦卤中通入Cl2后的溶液中溴的浓度极低,所以工业上一般要向该溶液中通入热空气,吹出的溴蒸气用二氧化硫水溶液吸收,再向吸收液中通入氯气得到较高浓度的溴水,写出溴与二氧化硫水溶液反应的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com