
【题目】已知工业制氢气的反应为CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
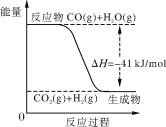
(1)增加H2O(g)的浓度,CO的转化率将________(填“增大”、“减小”或“不变”)。
(2)平衡常数的表达式K=________。400 ℃时平衡常数K______9(填“>”、“<” 或“=”)。
(3)已知2H2(g)+O2(g) ![]() 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:____。
2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:____。
【答案】增大 c(CO2)c(H2)/ c(CO)c(H2O) > 2CO(g) + O2(g) = 2CO2(g) ΔH=—566KJ/mol
【解析】
(1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,从图上可见反应放热,降温平衡正向移动,K增大;
(3)利用盖斯定律,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得。
(1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,所以K=![]() ;从图上可见反应放热,降温平衡正向移动,K增大,即400 ℃时平衡常数K>9;
;从图上可见反应放热,降温平衡正向移动,K增大,即400 ℃时平衡常数K>9;
(3)已知:①CO(g)+H2O(g)CO2(g)+H2(g)△H=-41KJ/mol,②2H2(g)+O2(g)2H2O(g)△H=-484kJ/mol,据盖斯定律①×2+②得:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(g) ![]() 2C(g),恒温恒压下,在密闭容器中充入1 mol A和2 mol B后的容积为3L。
2C(g),恒温恒压下,在密闭容器中充入1 mol A和2 mol B后的容积为3L。
(1)下列能用于判断该反应达到平衡的是(填字母):__________________。
a.A、B的浓度之比为1∶2 b.容器内气体的总物质的量不变
c.容器内气体密度不再变化 d.生成0.2 mol A的同时生成0.2 mol C
(2)平衡后,再向容器中通入1 mol氦气,A的转化率___________(填“增大”、“不变”、“减小”)。
(3)在T1、T2不同温度下,C的体积分数与时间关系如图所示。则T1 ______T2(填“大于”或“小于”,下同),该反应的△H __________0。若在T1下达到平衡,K(T1)=_____。(计算结果)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每次取20 g海水,严格按照过滤、蒸发、冷却、称量、计算的实验步骤规范操作,连续实验三次,平均得固态盐a g。该海水中含氯化钠的质量分数是( )
A.大于5a%
B.小于5a%
C.等于5a%
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出符合要求的一个反应:
①吸热的分解反应的化学方程式:______________________。
②表示一类放热反应的离子方程式:____________________。
(2)化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知: N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;由N2和H2合成1 mol NH3时可放出46.2 kJ的热量。则N—H键的键能是_______。
(3)根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1;
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ·mol-1;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.5 kJ·mol-1。
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化钌广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。现以固体含Ru废料为原料制备RuCl3晶体,其工艺流程如下:
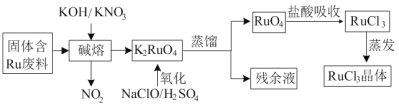
回答下列问题:
(1)K2RuO4中Ru的化合价为_____,“碱熔”中产生的气体可用于____(写一种工业用途)。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,则需要氧化剂的物质的量为______mol。
(3)为了提高“碱熔”效率,可以采取的措施有______。
(4)RuO4气体有剧毒,“盐酸吸收”时的化学方程式为___________。
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2 = 2Ru+6HCl,所得实验数据记录如下:
实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.1875 | 2.0210 |
② | 5.1875 | 2.0190 |
③ | 5.1875 | 2.0200 |
④ | 5.1875 | 1.6200 |
则产品的纯度为________(用百分数表示)。
(6)钌及其化合物在合成工业上有广泛用途,根据图示写出合成反应的化学方程式________。
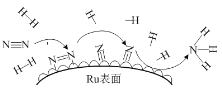
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2X(g)+Y(g)![]() 2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如图所示,下列判断正确的是( )
2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如图所示,下列判断正确的是( )
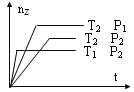
A.P1>P2 T1>T2 ΔH<0
B.P1>P2 T1<T2 ΔH<0
C.P1<P2 T1>T2 ΔH>0
D.P1<P2 T1<T2 ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是( )
A.氯化铝溶液与过量氨水反应:3NH3H2O+Al3+=Al(OH)3↓+3NH4+
B.向氢氧化钠溶液中通入过量的CO2气体:CO2+2OH-=CO32-+H2O
C.FeCl3溶液与Cu粉反应:Cu+Fe3+=Cu2++Fe2+
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com