
【题目】每次取20 g海水,严格按照过滤、蒸发、冷却、称量、计算的实验步骤规范操作,连续实验三次,平均得固态盐a g。该海水中含氯化钠的质量分数是( )
A.大于5a%
B.小于5a%
C.等于5a%
D.无法判断
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g) ΔH1;2H2(g)+O2(g)=2H2O(l) ΔH2
B.S(s)+O2(g)=SO2(g) ΔH1; S(g)+O2(g)=SO2(g) ΔH2
C.![]() ΔH1;C(s)+O2(g)=CO2(g) ΔH2
ΔH1;C(s)+O2(g)=CO2(g) ΔH2
D.H2(g)+Cl2(g)=2HCl(g) ΔH1; ![]() ΔH2
ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
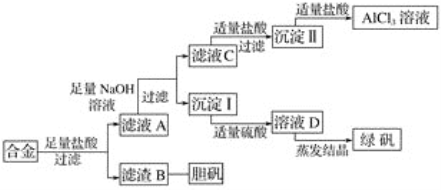
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:_____________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________________________________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为____________________________________________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理”或“不合理”),理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,
,![]() 。298K时,
。298K时,![]() ,
,![]() ,
,![]() 。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
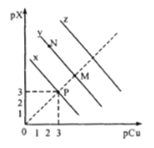
A.298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B.图中x代表CuI曲线,且P点c(Cu+)=c(Cl-)
C.298K时增大M点的阴离子浓度,则y上的点向N点移动
D.298K时![]() 的平衡常数K的数量级为103或102
的平衡常数K的数量级为103或102
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色晶体,常用作催化剂和陶瓷着色剂,为确定其组成,某小组进行了实验探究。
(查阅资料)碱式碳酸镍300℃以上时分解生成3种氧化物。NiO为绿色粉末,Ni2O3为灰黑色固体。
(实验探究)选用下图所示部分装置进行实验(夹持装置略)
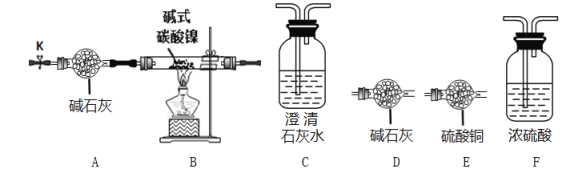
实验I定性探究:确定3种氧化物的组成。
(1)预测三种氧化物分别是含Ni、H、、C三种元素的理论依据是___________________。
(2)经检验生成的三种氧化物分别为NiO、H2O和CO2,装置连接顺序为AB__________(填装置的字母序号)。其中装置B现象为_________________。
实验II 定量确定碱式碳酸镍的组成。连接装置A-B-F-D-D进行实验。
实验步骤如下:
i 称量碱式碳酸镍、装置F、装置D(前一个)的质量并记录
ii 打开活塞K,缓缓通入空气
iii点燃酒精灯,加热
iv熄灭酒精灯, 冷却到室温, 关闭K
v 再次称量装置F、装置D(前一个)的质量并记录
(3)其中步骤ii的目的是_____________________________________。
(4)若缺少装置A将导致所测得的x值___________(填“偏大”或“偏小”或“无影响”)。
(5)重复操作ii-v至__________________________时,可判断碱式碳酸镍已完全分解。
(6)实验前测得石英玻璃管中的样品质量为3.77g,其他数据如下表所示
装置F质量/g | 装置D(前一个)质量/g | |
实验前 | 132.00 | 41.00 |
实验后 | 133.08 | 41.44 |
该碱式碳酸镍的化学式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国工程院院士、国家卫健委高级别专家组成员李兰娟团队,于2月4日公布阿比朵尔、达芦那韦可抑制新型病毒。如图所示有机物是合成阿比朵尔的原料,关于该有机物下列说法正确的是
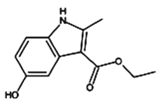
A.分子式为C12H14NO3
B.易溶于水和有机溶剂
C.分子结构中含有三种含氧官能团
D.可以发生加成反应、取代反应、水解反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500℃时,将4molSO2与2molO2放入4L的密闭容器中,5分钟后反应达到平衡:2SO2+O2![]() 2SO3,测得平衡时SO3的浓度为0.5mol·L-1。
2SO3,测得平衡时SO3的浓度为0.5mol·L-1。
(1)在500℃时,该反应平衡常数K=_____
(2)反应达到平衡时,SO2的转化率为______
(3)从开始反应至达到平衡状态 反应速率v(O2)=_____
(4)该反应在低温时能自发进行,则该反应的正反应是_____(填“放热”或“吸热”)反应
(5)在500℃时,在2L的密闭容器中,发生上述反应,某一时刻测得容器内SO2、O2、SO3的物质的量分别为1mol、2mol、2mol则此时正逆反应速率大小为v(正)____v(逆)(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:Ⅰ.2SO2(g)+O2(g)+2H2O(l)=2H2SO4(aq)ΔH1;
Ⅱ.Cl2(g)+H2O(l)![]() HCl(aq)+HClO(aq)ΔH2;
HCl(aq)+HClO(aq)ΔH2;
Ⅲ.2HClO(aq)=2HCl(aq)+O2(g)ΔH3;
SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq)
ΔH4=____________________(用含有ΔH1、ΔH2和ΔH3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。
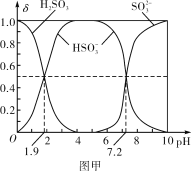
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因_____________________________________________________。
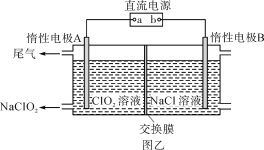
(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图乙所示。
①交换膜应选用____________________(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____________________________________。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)![]() S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
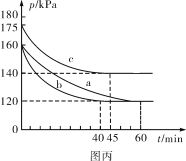
(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图丙所示:
①图丙中三组实验从反应开始至达到平衡时,v(CO)最大的为__________(填字母序号)。
②与实验a相比,c组改变的实验条件可能是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
A. 体积不变,充入氮气使压强增大 B. 体积缩小一半
C. 压强不变,充入氮气使体积增大 D. 升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com