
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )

A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
科目:高中化学 来源: 题型:
【题目】醋酸在水中电离方程式可表示为:CH3COOH![]() CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
A. 加入少量NaOH固体 B. 小心加热升温10oC C. 加入锌粉 D. 加入固体CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸分子的结构式可表示为 ,下列叙述正确的是:
,下列叙述正确的是:
(1)乙酸的电离,是①键断裂
(2)乙酸与乙醇发生酯化反应,是②键断裂
(3)在红磷存在时,Br2与乙酸发生反应CH3COOH+Br2![]() CH2BrCOOH+HBr是③键断裂
CH2BrCOOH+HBr是③键断裂
A.(1)(2)B.(1)(2)(3)C.(2) (3)D.(1)(3)、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质与原子结构、元素在周期表中的位置有着密切的关系。回答下列问题:
(1)如图表示某短周期元素X的前五级电离能(I)的对数值,试推测并写出X的元素符号___。
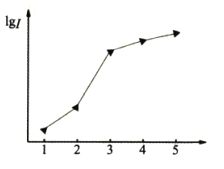
(2)化合物甲与SO2所含元素种类相同,两者互为等电子体,请写出甲的化学式___,甲分子中心原子的杂化类型是___。
(3)配位化学创始人维尔纳发现,将1mo1CoC13·5NH3(紫红色)和1mo1CoC134NH3(绿色)溶于水,加入AgNO3溶液,立即沉淀的AgCl分别为2mo1、1mol。则紫红色配合物中配离子的化学式为___,绿色配合物中Co的配位数为___。
(4)某稀土元素M的氧化物晶体为立方晶胞,其结构如图所示,图中小球代表氧离子,大球代表M离子。
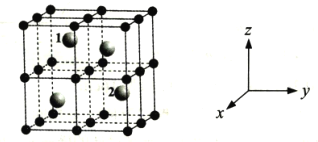
①写出该氧化物的化学式___。
②己知该晶体密度为ρg·cm-3,晶胞参数为anm,NA为阿伏加德罗常数的值。则M的相对原子质量Mr=___(用含ρ、a等的代数式表示);
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1(M原子)的坐标为(![]() ,
,![]() ,
,![]() ),则原子2(M原子)的坐标为___。
),则原子2(M原子)的坐标为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中a、b、c、d、e为周期表短周期的一部分元素,下列叙述正确的是( )

A. b元素除0价外,只有一种化合价
B. a的晶体中只有一种作用力
C. b、e简单气态氢化物的稳定性:b<e
D. d元素的第一电离能是同周期元素中最大的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
B. H2O是极性分子,分子中O原子处在2个H原子所连成的直线的中央
C. CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央
D. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
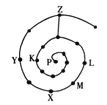
A.L、M、X三元素位于同一族
B.K、Z两元素的氢化物的水溶液都显酸性
C.Y元素对应的氢化物比K元素对应的氢化物沸点低
D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是_______,ΔH3=_______kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(ψ)如图所示。
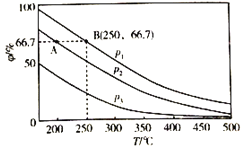
①其中,p1,p2和p3由大到小的顺序是_______,其原因是_______。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)_______vB(N2)(填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_______Pa(分压=总压×物质的量分数,保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院深圳先进技术研究院成功研发了一种高效低成本储能电池——“铝一石墨”双离子电池,电池总反应为Al+xC+Li++PF6 -![]() AlLi+Cx PF6下列有关该电池的说法正确的是
AlLi+Cx PF6下列有关该电池的说法正确的是
A. 放电时,PF6-向正极移动
B. 放电时,负极反应为A1-3e-====Al3+
C. 充电时,两个电极增加的质量相等
D. 充电时,阳极反应为xC+PF6--e-==CxPF6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com