
【题目】下列各组离子能够大量共存的是
A. Ag+、NH4+、CO32-、H+ B. Fe3+、H+、SCN-、NO3-
C. Na+、Fe2+、Cl-、NO3- D. H+、MnO4+、Cl-、NO3-
科目:高中化学 来源: 题型:
【题目】用16mol/L 浓硫酸配制100mL 2.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题
(1)该实验所需的玻璃仪器:___________、玻璃棒、烧杯、胶头滴管、量筒。
(2)所需浓硫酸的体积是______,量取浓硫酸所用的量筒的规格是_______(规格从下列中选用 A.10mL B.20mL C.50mL D.100mL)
(3)第⑤步定容的具体实验操作是_______________________________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.容量瓶用蒸馏水洗涤后残留有少量的水__________。
B.转移溶液前未冷却至室温____________。
C.定容时仰视溶液的凹液面____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某铜和氧化铜的混合物中铜元素的质量分数,某同学设计了如图所示实验装置。
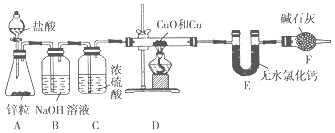
回答下列问题:
(1))装置A中盛装盐酸的仪器的名称为____________。
(2)实验时装置A中可观察到的现象________________________________________ ;发生反应的离子方程式为__________________________________________________。
(3)装置B的作用是_______________________________________________________。
(4)在加热装置D之前,应该进行的一步操作是________________________________,目的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含Al3+为1.08 g的明矾(化学式:KAl(SO4)212H2O)溶于水配成200 mL溶液,在该溶液中加入0.1 mol/L Ba(OH)2溶液200 mL,反应后溶液中SO42-的物质的量浓度为(忽略溶液体积变化)
A. 0.6 molL-1 B. 0.3 molL-1 C. 0.15 molL-1 D. 0.075 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g) ![]() CH3OH(g) △H2
CH3OH(g) △H2
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。

(1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。
(2)反应①的△H1____0,图中的P1______P2(填“<”、“=”或“>”)。
(3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2____0,△S____0(填“<”、“=”或“>”)。
(4)根据题中给出的数据,计算反应①在100℃时的平衡常数值____________(写出计算过程及结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等质量的铜片、银片、铁片、锌片分别置于四个小烧杯中,然后分别加足量的浓硝酸,放出NO2气体最多的是
A.铜片 B.银片 C.铁片 D.锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A的质子数等于周期数,B与C的 P轨道均有三个成单电子,D的最高正价与最低负价代数和为4,E的最外层只有一个电子, 内层轨道处于全充满状态。试回答下列问题。
(1)基态E原子的电子排布式为_________;C和D的第一电离能较大的________(填元素符号)。
(2)DO32-中D原子的杂化类型为_________;A、D和氧元素组成的液态化合物A2DO4中存在的作用力有_____________。
(3)结构式为A—B=B—A的分子中σ键和π键的数目比为________;B2分子和NO+离子互为等离子体,则NO+的电子式为___________。
(4)向EDO4溶液中加入过量稀氨水,其化学方程式为_______________;产物中阳离子的配体是_____________(填化学式)。
(5)D(黑球)和E(白球)形成某种晶体的晶胞如图所示。已知该晶体的晶胞边长为516Pm,则黑球和白球之间最近距离为________pm(精确到0.1,已知![]() =1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。
=1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一、选用正确的实验操作,将下列各组物质进行分离或提纯。
A.分液B.过滤C.萃取D.蒸馏 E.蒸发结晶 F.高温分解
(1)分离CC14和H2O:________________(填字母,下同)。
(2)除去石灰水中的CaCO3:________________。
(3)除去CaO固体中少量的CaCO3固体: ________________。
(4)从碘水中提取碘:____________。
(5)分离乙醇(沸点为78 °C)和甲苯(沸点为110.6°C)的液体混合物:__________。
二、蒸馏是实验室制备蒸馏水的常用方法


图一 图二
(1)图Ⅰ是实验室制取蒸馏水的常用装置,图中明显的一个错误是____________________。
(2)仪器A的名称是______________,仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入几粒__________,其作用是防止液体暴沸。
(4)从锥形瓶取少量收集到的液体于试管中,然后滴入____________和____________(填试剂的化学式),检验是否存在氯离子。
(5)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是______________;烧杯中最好盛有的物质是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com