
【题目】将含Al3+为1.08 g的明矾(化学式:KAl(SO4)212H2O)溶于水配成200 mL溶液,在该溶液中加入0.1 mol/L Ba(OH)2溶液200 mL,反应后溶液中SO42-的物质的量浓度为(忽略溶液体积变化)
A. 0.6 molL-1 B. 0.3 molL-1 C. 0.15 molL-1 D. 0.075 molL-1
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. 碳酸氢钠可用于治疗胃酸过多 B. 二氧化氯可用于生活用水消毒
C. 碳纳米管属于有机高分子材料,可用于储存氢气 D. 过氧化钠可用于呼吸面具供氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子在指定的分散系中能大量共存的一组是( )
A.无色溶液:K+、Cu2+、NO3﹣、AlO2﹣
B.空气: CH4、CO2、SO2、NO
C.氢氧化铁胶体: H+、K+、S2-、Br -
D.各离子物质的量浓度相等的溶液:K+、Mg 2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
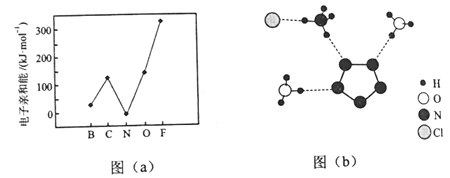
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。
(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性
B. 油脂是高级脂肪酸的甘油酯,均不能发生氢化反应
C. H2N—CH2——COOH既能与盐酸反应,又能与氢氧化钠溶液反应
D. 在蛋白质的渗析、盐析、变性过程中都发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1 molL-1的NaCl溶液是指此溶液中含有0.1 mol NaCl
B. 1 molL-1的BaCl2溶液中,Cl-的物质的量浓度为2 molL-1
C. 从1 L 0.5 molL-1的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.05 molL-1
D. 在![]() 和
和![]() 的混合水溶液中,如果
的混合水溶液中,如果![]() 和
和![]() 的物质的量浓度相等,则
的物质的量浓度相等,则![]() 和
和![]() 的物质的量浓度相同
的物质的量浓度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能够大量共存的是
A. Ag+、NH4+、CO32-、H+ B. Fe3+、H+、SCN-、NO3-
C. Na+、Fe2+、Cl-、NO3- D. H+、MnO4+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐。粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。某同学用某种粗盐进行提纯实验,步骤见下图。请回答下列问题:
![]()

(1)在完成操作Ⅰ之前,必须加入的X物质是___________________。
(2)操作Ⅰ和操作Ⅱ的名称是__________________________。该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是___________________________(填序号)。

(3)在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取_____________________________________________________等措施。
(4)判断加入的盐酸“适量”的方法是_______________________________________________________________________________。
(5)实验所得精盐的质量___________________________(填“大于”、“小于”或“等于”)粗盐中NaCl的质量,原因是_________________________________________________________________________________。
(6)猜想和验证:(并完成相应填空)
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:沉淀物A中含CaCO3、MgCO3 | 取少量沉淀物A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | __________ | 猜想Ⅰ成立 |
猜想Ⅱ:沉淀物A中含BaCO3 | 取少量沉淀物A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ______ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,____________________ | __________ | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A. 升高温度,K减小 B. 减小压强,n(CO2)增加
C. 更换高效催化剂,α(CO)增大 D. 充入一定量的氮气,n(H2)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com