
| A. | 原子最外层电子数等于或大于3的元素一定是主族元素 | |
| B. | 原子最外层只有1个电子的元素一定是第IA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定位于第二周期 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
分析 A.副族元素最外层有1-2个电子,稀有气体的最外层电子数为2或8;
B.原子最外层只有1个电子的元素,可能为副族元素;
C.每层容纳的电子为2n2个,无论哪层为最外层时,最外层电子不超过8个;
D.某元素的离子最外层电子数与次外层电子数相同,可能为第四周期的金属阳离子.
解答 解:A.副族元素最外层有1-2个电子,稀有气体的最外层电子数可为8,则原子最外层电子数等于或大于3的元素不一定是主族元素,故A错误;
B.原子最外层只有1个电子的元素,可能为副族元素,如副族元素Cr,故B错误;
C.每层容纳的电子为2n2个,无论哪层为最外层时,最外层电子不超过8个,显然外层电子数比次外层电子数多的元素一定位于第二周期,故C正确;
D.某元素的离子最外层电子数与次外层电子数相同,该元素不一定位于第三周期,可能为第四周期的K、Ca等,故D错误;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、周期表的结构为解答的关键,侧重分析与应用能力的考查,注意副族元素的电子排布,题目难度不大.


科目:高中化学 来源: 题型:选择题
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 简单离子半径:T>R |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内原子总数不变 | B. | 容器内压强不变 | ||
| C. | 容器内分子总数不变 | D. | 发生的反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
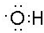 ;
;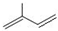 ;
;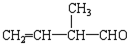 所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型:  ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为  |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaHCO3溶液产生气体,表示含有-COOH或酚羟基 | |
| B. | 遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质 | |
| C. | 加入新制的Cu(OH)2悬浊液,加热煮沸有红色沉淀生成,或加入银氨溶液加热有银镜生成,表示含有-CHO | |
| D. | 某有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④ | C. | ①⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二甲基己烷 | D. | 2,5一二甲基己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com