
【题目】制取漂白粉的反应为_______。漂白粉的主要成分为_______,有效成分为_______。漂白原理为_______,HClO不仅有漂白作用,还有消毒作用,HClO的不稳定性_______(用方程式表示)。
科目:高中化学 来源: 题型:
【题目】下列药品的保存错误的是( )
A.白磷放在水中
B.酒精等易燃物应敞口放置且远离火源
C.氯酸钾、硝酸铵不要同可燃物混放,防爆炸
D.浓硫酸与固体氢氧化钠都需要密封保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸在水中的电离方程式为:H2B=H++HB-; HB-![]() H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1)Na2B 溶液显__________(填“酸性、中性、或碱性”),理由是(用离子方程式表示):____________________________________________。
(2)在0.1mol/L 的Na2B 溶液中,下列粒子浓度关系正确的是__________。
A.c(B2-)+c(HB–)+c(H2B)=0.1 mol/L
B.c(Na+)+ c(H+)= c(HB–)+c(OH–) +2c(B2-)
C.c(Na+)=2c(HB–) +2c(B2-)
D. c(H+)=c(OH–)-c(HB–)-2c(H2B)
(3)已知0.1 mol/LNaHB溶液的pH=2,则0.1 mol/LH2B溶液中c(H+)可能是_____0.11mol/L(填“<”、“>”或“=”),理由是_______________________。
(4)0.1mol/LNaHB溶液中各种离子浓度大小为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请结合下列有机物回答相关问题,
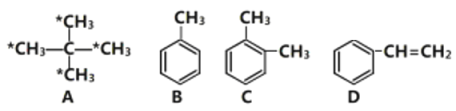
(1)有机物A的名称___________,标注“*”的碳原子连接起来构成的图形为________(填“菱形”、“正方形”或“正四面体形”)。E是A的同系物,且比A少一个碳原子,则E的一氯代物有______种。
(2)相同质量的上述四种有机物完全燃烧时耗氧量最大的是_______________(填结构简式)。
(3)有机物B能实现如下转化:
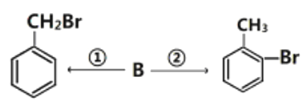
各步转化的反应条件为①_______________;②_______________。
(4)有机物D的官能团名称为_______________,D在一定条件下能生成高分子化合物的反应化学方程式为___________________________________________________________。
(5)下图是与乙醇有关的两个实验,
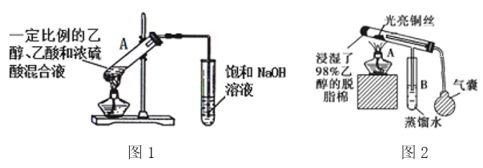
①图1试管A中的反应方程式为______________________________,浓硫酸的作用是_________。请指出图1中两处明显的错误_________________________________________。
②点燃图2中酒精灯,反复挤压气囊,向图2装置中鼓入空气,铜丝反复出现由红变黑又由黑变红的现象,其中铜丝由黑变红的原因是__________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关人体内物质的功能叙述,不正确的是( )
A. Na+和Cl-是决定细胞外液渗透压的主要物质
B. 自由水在体内的流动有利于细胞的新陈代谢
C. 胰岛素等蛋白类激素能调节机体的生命活动
D. 淀粉、糖原和脂肪都是人体细胞内的储能物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个制取氯气并以氯气为原料进行某些反应的装置(夹持和加热装置省略)。
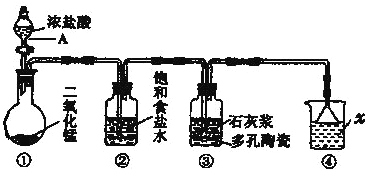
(1)写出图中仪器A的名称_______。
(2)装置中x试剂为_______;装置中饱和食盐水的作用是_______。
(3)装置③中发生反应的化学方程式为______。
(4)若将生成的C12通入淀粉碘化钾无色溶液中,可观察到溶液变成_______色,反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3采用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略》及相关信息如下。
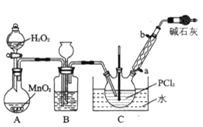
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ―112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈 水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为_______________________________;
(2)装置C中生成POCl3的化学方程式为________________________________;
(3)实验中需控制通入O2的速率,对此采取的操作是_________________________________;
(4)装置B的作用除观察O2的流速之外,还有___________________________________;
(5)反应温度应控制在60~65℃,原因是__________________________________;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液。
(6)达到终点时的现象是_________________________________________;
(7)测得产品中n(POCl3)= ___________________________;
(8)已知Ksp(AgCl)> Ksp(AgSCN),据此判断,若取消步骤③,滴定结果将_______。(填偏高,偏低,或不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com