
【题目】某校化学实验兴趣小组为了探究在实验室制备 Cl2 的过程中有水蒸气和 HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置 ( 支撑用的铁架台省略 ),按要求回答问题.
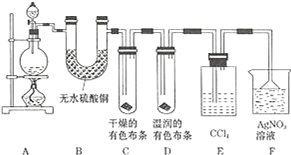
(1)下列方法中,可制得氯气的正确组合是___.(已知酸性条件下,K2Cr2O7、KClO3的氧化性均强于Cl2;酒精灯可以不用)
①MnO2 和浓盐酸混合共热; ②次氯酸钠和浓盐酸混合;③K2Cr2O7 和浓盐酸混合; ④KClO3 和浓盐酸混合共热;⑤KMnO4和浓盐酸混合;
A 只有① B 只有①⑤ C 只有①③④⑤ D 全部可以
(2)若用含有 0.2mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2,制得的 Cl2 体积 ( 标准状况下 )总是小于1.12L的原因是___.
(3)装置 B 的作用____,现象是____.
(4)装置 C 和 D 出现的不同现象说明的问题是___、装置 E 的作用是____.
(5)写出装置 F 中发生反应的离子方程式____.
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入 AgNO3 溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在__与__之间 ( 填装置字母序号 ),装置中应放入___.
【答案】D 浓盐酸的浓度随着反应的进行变稀以后,将不再反应;加热时浓盐酸因挥发而损失 证明有水蒸气产生 白色变蓝色 氯气无漂白性、次氯酸有漂白性 吸收氯气 Ag++Cl﹣=AgCl↓ E F 湿润的淀粉KI试纸(或湿润的有色布条)
【解析】
(1)利用强氧化剂氧化氯离子生成氯气;
(2)二氧化锰与浓盐酸反应,与稀盐酸不反应;
(3)硫酸铜吸水生成蓝色硫酸铜晶体,检验是否含有水蒸气;
(4)干燥的氯气不能使有色物质褪色,氯气不具有漂白性;氯气易溶于有机溶剂,四氯化碳吸收氯气,防止干扰F中氯化氢的检验;
(5)加入F中的气体为氯化氢,与硝酸银反应;
(6)氯气与水反应会生成盐酸,干扰F中氯化氢的检验,故在E、F之间用碘化钾淀粉试液检验氯气是否被完全吸收。
(1)①MnO2和浓盐酸混合共热,②MnO2、NaCl和浓硫酸混合共热,③次氯酸钠和浓盐酸混合,④KClO3和浓盐酸混合共热,⑤KMnO4和浓盐酸混和,都是实验室常用制备氯气的方法;
答案选D;
(2)浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,反应消耗氯化氢,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不反应不与MnO2反应,
故答案为:加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应;
(3)硫酸铜吸水生成蓝色硫酸铜晶体,检验含有水蒸气,
故答案为:证明有水蒸气产生;白色固体变蓝色;
(4)干燥的有色布条不褪色,说明氯气不具有漂白性;湿润的有色布条褪色,氯气与水反应生成盐酸与次氯酸,盐酸不具有漂白性,所以使有色布条褪色的物质是次氯酸,故次氯酸漂白性,用四氯化碳吸收氯气,防止干扰F中氯化氢的检验,
故答案为:干燥氯气无漂白性,次氯酸有漂白性;吸收氯气;
(5)氯化氢与硝酸银反应生成氯化银和硝酸,反应离子方程式为Ag++Cl-=AgCl↓;
(6)氯气与水反应会生成盐酸,干扰F中氯化氢的检验,故在E、F之间加一装置,用湿润的淀粉碘化钾试纸或湿润的有色布条检验氯气是否被完全吸收,
故答案为:E F;湿润的淀粉KI试纸(或湿润的有色布条)。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的二份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克。下列说法正确的是( )
A.该溶液中不一定含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+)≥0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,各物质的浓度随时间的变化如图1所示,请回答下列问题:

(1)图1中,曲线_______(填“X”或“Y”)表示NO2浓度随时间的变化情况,前10min内v(NO2)=_______mol/(L· min);
(2)下列选项中不能说明该反应已达到平衡状态的是____(填选项字母)
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均相对分子质量不随时间变化而改变
(3)反应进行到10min时,共吸收热量22.76kJ,则该反应的热化学反应方程式为______________________,该反应的平衡常数K=_____________;
(4)反应进行到20min时,再向容器内充入一定量的NO2,10min后达到新平衡,此时测得c(NO2)=0.9mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中的NO2的体积分数为w2,则w1______w2(填“>”“=”或“<”)
②请在图2中画出20min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”,且要体现出始状态与末状态要用具体浓度)________________
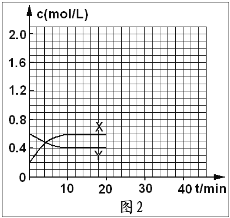
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
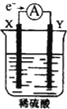
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
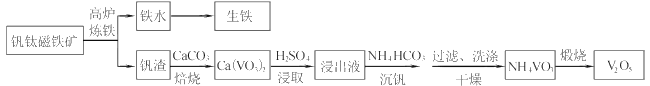
已知:①VO3-+2H+![]() VO2++H2O
VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法 B.热还原法 C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式__。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_,浸出液中含钒物质的化学式为___。
(4)沉钒过程有气体生成,其反应的离子方程式为__。
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__。
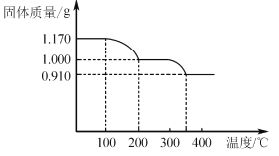
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为__,300~350℃放出的气态物质化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某弱酸的酸式盐有NaH2XO4和Na2HXO4两种,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,NaH2XO4溶液和Na2HXO4溶液,二种溶液的浓度均为0.1mol·L-1,其中均存在的关系是( )
A.c(H+)·c(OH-)=1×10-14
B.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-)
C.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-)
D.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?)![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
A.①中的I2为固态,②中的I2为气态
B.②的反应物总能量比①的反应物总能量低
C.①的产物比反应②的产物热稳定性更好
D.1mol 固态碘升华时将吸热17kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法不正确的是

A. 放电时,负极反应式:Li-e- =Li+
B. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗标准状况下11.2 L O2
C. 放电时,随外电路中电子的转移,水性电解液中离子总数减少
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com